
����Ŀ�����Ĺ̶��͵���ѭ���Ǽ���������ѧ��һֱ�о��Ŀ��⡣
(1)�±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���K ֵ��
��Ӧ | �����̵�N2(g)+O2(g) | ��ҵ�̵�N2(g)+3H2(g) | |||
�¶�/�� | 27 | 2000 | 25 | 400 | 450 |
K | 3.84��10-31 | 0.1 | 5��108 | 0.507 | 0.152 |
�ٷ������ݿ�֪������ʺϴ��ģģ������̵���ԭ��____��
�ڴ�ƽ���ӽǿ��ǹ�ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ�� 500�����ҵĸ��£� ��������ܵ�ԭ��_____��
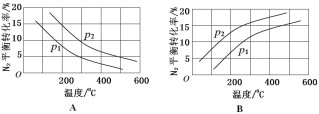
(2)��ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨ N2 ��ƽ��ת�����ڲ�ͬѹǿ(��1����2)�����¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ����_____(�A����B��)���Ƚ���1����2�Ĵ�С��ϵ_____��
(3)��ͼ��ijѹǿ�£�N2 ��H2 �������1��3Ͷ��ʱ����Ӧ������а�������������¶ȵı仯���ߡ�����һ���Ǿ���һ��ʱ�䷴Ӧ������ߣ���һ����ƽ��ʱ�����ߡ�
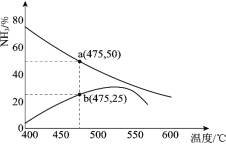
��ͼ��b �㣬v(��)_____v(��)��(�����������������)
��ͼ��a �㣬���������� n(N2):n(NH3)=_____��
(4)��֪��N2(g)+3H2(g)![]() 2NH3(g)��H����92.4kJ��mol��1��2H2(g) +O2(g)
2NH3(g)��H����92.4kJ��mol��1��2H2(g) +O2(g)![]() 2H2O(l)��H����575.6kJ��mol��1�����꣬���п�ѧ������ڳ��¡���ѹ�������������µ�����Һ̬ˮ�ϳɰ�����ͬʱ������������˼·����÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��_____��
2H2O(l)��H����575.6kJ��mol��1�����꣬���п�ѧ������ڳ��¡���ѹ�������������µ�����Һ̬ˮ�ϳɰ�����ͬʱ������������˼·����÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��_____��
(5)NH3��һ�������¿ɱ�������
��֪������4NH3(g)+3O2(g)��2N2(g)+6H2O(g)��H����1298kJ/mol
����
�� �Ͽ� 1 mol H-O ����Ͽ� 1 mol H-N �������������Լ_____kJ��
�� H-O ���� H-N ��(�ǿ��������)_____��
���𰸡������̵�Ϊ���ȷ�Ӧ���¶ȸߴ�2000��ʱ��Kֵ��Ȼ��С��������еij̶Ⱥ�С��ת���ʺܵͣ����ʺϴ��ģ���� �¶���500������ʱ����������ߣ���Ӧ���ʽϿ죬�ﵽƽ����Ҫ��ʱ��϶̣��ӷ�Ӧ���ʺʹ����Ļ��ԵȽǶȿ��ǣ�ѡ��500�����Ҹ����� A p2��p1 �� 1��4 2N2(g)+6H2O(l)4NH3(g)+3O2(g) ��H=+1542 kJmol-1 75 ǿ
��������
(1)�����¶ȶԻ�ѧƽ�ⳣ��K��Ӱ����K�ĺ���������
(2)�ϳɰ���ӦΪ���������С�ķ��ȷ�Ӧ������¶Ⱥ�ѹǿ��ƽ���ƶ���Ӱ��������
(3)����ͼ����Ӱ��ƽ������أ�a������������ƽ�����ߡ�b�����������Ǿ���һ��ʱ�䷴Ӧ������ߣ��������ʽ������
(4)���ݸ�˹���ɷ������
(5)�����ʱ���H=��Ӧ��ļ���֮��-������ļ���֮�ͼ�����
(1)���ɱ������ݿ�֪���ɱ������ݿ�֪���¶�Խ�ߣ������̵���Ӧ��KԽ��˵�������̵��ķ�ӦΪ���ȷ�Ӧ��2000��ʱ��K=0.1��Kֵ��С����ת���ʺ�С�����ʺϴ��ģ��������������ʺϴ��ģģ������̵����ʴ�Ϊ�������̵�Ϊ���ȷ�Ӧ���¶ȸߴ�2000��ʱ��Kֵ����С��������еij̶Ⱥ�С��ת���ʺܵͣ����ʺϴ��ģ������
���ɱ������ݿ�֪���¶�Խ�ߣ��ϳɰ���Ӧ��KԽС��˵���ϳɰ����ķ�ӦΪ���ȷ�Ӧ���ϳɰ���Ӧ�У��¶�Խ�ߣ���Ӧ����Խ�죬���Ǹ÷�ӦΪ���ȷ�Ӧ���¶ȸ�ת���ʻή�ͣ���500�����Ҵ���������ߣ����ԴӴ������Ե��ۺ����ؿ���ѡ��500����������ʣ��ʴ�Ϊ���¶���500�����Ҵ���������ߣ���Ӧ���ʽϿ죬�ﵽƽ����Ҫ��ʱ��϶̣��ӷ�Ӧ���ʺʹ����Ļ��ԵȽǶȿ��ǣ�ѡ��500�����Ҹ����ʣ�
(2)�ϳɰ���ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ���ת���ʼ�С������ͼA��ȷ��B����ӦN2 (g)+3H2 (g) 2NH3(g)��������Ϊ�����С�ķ�Ӧ������ѹǿ��ƽ�������ƶ���ת��������p2��ת���ʴ���p2�ʴ�Ϊ��A��p2��p1��
(3) ����ͼ֪��a������������ƽ�����ߡ�b�����������Ǿ���һ��ʱ�䷴Ӧ������ߡ�
��ͼ��b�㣬������������������ӣ���֪������Ӧ�����ƶ�������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ������
��ͼ��a�㣬�跴Ӧ��N2Ϊx��
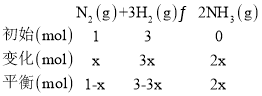
ƽ��ʱ���������������Ϊ50%ʱ����![]() =50%����ã�x=
=50%����ã�x=![]() ����n(N2)��n(NH3)=
����n(N2)��n(NH3)=![]() ��
��![]() =1��4���ʴ�Ϊ��1��4��
=1��4���ʴ�Ϊ��1��4��
(4)��N2(g)+3H2(g)2NH3(g) ��H=-92.4kJmol-1����2H2(g)+O2(g)2H2O(l) ��H=-575.6kJmol-1���ɸ�˹���ɣ��١�2-�ڡ�3��2N2(g)+6H2O(l)4NH3(g)+3O2(g) ��H=(-92.4kJmol-1)��2-(-575.6kJmol-1)��3=+1542 kJmol-1���ʴ�Ϊ��2N2(g)+6H2O(l)4NH3(g)+3O2(g) ��H=+1542 kJmol-1��
(5)�ٸ���4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=-1298kJ/mol����֪12E(H-N)+3��498kJ/mol-2��946kJ/mol-12E(H-O)=-1298kJ/mol����E(H-O)- E(H-N)=75kJ/mol���ʴ�Ϊ��75��
�ڸ���E(H-O)- E(H-N)=75kJ/mol����֪H-O ����H-N��ǿ���ʴ�Ϊ��ǿ��


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ������ҹ���ѧ�����Ƴ���ʯīϩΪ����Ĵ������� 25������ H2O2 ֱ�ӽ� CH4ת��Ϊ�����л������Ҫԭ������ͼ��ʾ��
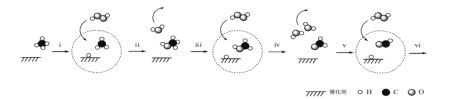
����˵������ȷ����
A.��ͼ�� ![]() ���� H2O2
���� H2O2
B.����ͼ��֪������ iv ���ɵ� H2O�����е� H ԭ��ȫ������ H2O2
C.���� i��ii ���ܷ�Ӧ����ʽ��CH4+H2O2![]() CH3OH+H2O
CH3OH+H2O
D.��������ԭ�����Ʋⲽ�� vi ���� HCOOH �� H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ������WԪ�ص�ԭ���������������ڲ��������2��������˵����ȷ����
![]()
A.ԭ�Ӱ뾶��С��W>Y>Z
B.X���⻯����Z���⻯����Է�����Ӧ
C.�������Ӧˮ��������ԣ�Z>Y>W
D.�⻯����ȶ��ԣ�Y>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ϵ��ǣ� ��
A.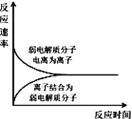 ��ʾ���������ˮ�н�������ƽ��Ĺ���
��ʾ���������ˮ�н�������ƽ��Ĺ���
B.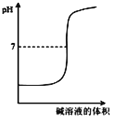 ��ʾǿ��ζ�ǿ��ĵζ�����
��ʾǿ��ζ�ǿ��ĵζ�����
C.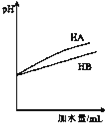 ��ʾ�������pH������HA��ǿ��HB��ˮϡ�����е�pH�仯����
��ʾ�������pH������HA��ǿ��HB��ˮϡ�����е�pH�仯����
D.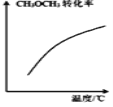 ��ʾ�ܱ�������
��ʾ�ܱ�������![]() �ﵽƽ���ѹ�����¶ȹ����У�
�ﵽƽ���ѹ�����¶ȹ����У�![]() ��ת���ʱ仯����
��ת���ʱ仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.10 mol/L�İ�ˮ�ζ�10.0 mLa mol/L�����ᣬ��Һ��pH�백ˮ���(V)�Ĺ�ϵ��ͼ��ʾ����֪��N����Һ�д��ڣ�c(Cl-)=c(NH4+)+c(NH3��H2O)������˵������ȷ����( )
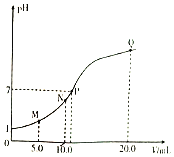
A.a=0.10
B.N��P������Һ��ˮ�ĵ���̶ȣ�N<P
C.M��N������Һ��NH4+�����ʵ���֮�ȴ���1��2
D.Q����Һ�д��ڣ�2c(OH-)-2c(H+)=c(NH4+)-c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���FeCl3�ֱ���Na2SO3��NaHSO3�ķ�Ӧ����̽����
����ͬѧ��ʵ�飩
װ�� | ��� | �Լ�X | ʵ������ |
| I | Na2SO3��Һ(pH��9) | �պϿ��غ�����������ָ�뷢��ƫת |
II | NaHSO3��Һ(pH��5) | �պϿ��غ�����������ָ��δ����ƫת |
(1)����FeCl3��Һʱ���Ƚ�FeCl3����Ũ���ᣬ��ϡ����ָ��Ũ�ȡ���ϻ�ѧ����˵��Ũ��������ã���
(2)��ͬѧ̽��ʵ��I�ĵ缫����______________��
��ȡ����Na2SO3��Һ�缫�����Ļ��Һ������______________��������ɫ������֤��������![]() ��
��
�ڸ�ͬѧ�����ʵ��̽����һ�缫�IJ����ʵ�鷽��Ϊ______________��
(3)ʵ��I�и����ĵ缫��ӦʽΪ______________��
����ͬѧ��ʵ�飩
��ͬѧ��һ��̽��FeCl3��Һ��NaHSO3��Һ�ܷ�����Ӧ����ơ����ʵ�鲢��¼���£�
װ�� | ��� | ��Ӧʱ�� | ʵ������ |
| III | 0~1 min | ������ɫ�������д̼�����ζ�����ݳ� |
1~30 min | ����Ѹ���ܽ��γɺ�ɫ��Һ�������Һ��Ϊ��ɫ��֮����ɫ | ||
30 min�� | ������Ӵ����ֵ��ϲ���Һ�ֱ�Ϊdz��ɫ�������Ϊdz��ɫ |
(4)��ͬѧ��Ϊ�̼�����ζ����IJ���ԭ�������ֿ��ܣ������ӷ���ʽ��ʾ�ڵĿ���ԭ��
�� Fe3+��3![]()
![]() Fe(OH)3 ��3SO2����______________��
Fe(OH)3 ��3SO2����______________��
(5)�������ϣ���Һ��Fe3+��![]() ��OH�����������γɺ�ɫ����ﲢ��������ת����
��OH�����������γɺ�ɫ����ﲢ��������ת����
![]()
�ӷ�Ӧ���ʺͻ�ѧƽ�������ǶȽ���1~30 min��ʵ������______________��
(6)����30 min���ϲ���Һ�ֱ�Ϊdz��ɫ�Ŀ���ԭ��______________��
��ʵ�鷴˼��
(7)�ֱ�Ա�I��II��II��III��FeCl3�ܷ���Na2SO3��NaHSO3����������ԭ��Ӧ���й�(д������)______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[Zn(CN)4]2-��ˮ��Һ����HCHO�������·�Ӧ��4HCHO��[Zn(CN)4]2+4H��+4H2O= [Zn(H2O)4]2++4HOCH2CN��HOCH2CN�Ľṹ��ʽ����ͼ��ʾ������˵������ȷ����
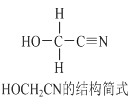
A. HOCH2CN������û������̼ԭ��
B. 1mol HOCH2CN�����к������������ʵ���Ϊ5mol
C. [Zn(CN)4]2-��[Zn(H2O)4]2+������ԭ����λ����Ϊ4
D. HOCH2CN������̼ԭ�ӹ�����ӻ����ͷֱ���sp3��sp�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CuSO4��5H2O��д[Cu(H2O)4]SO4��H2O����ṹʾ��ͼ���£�

�����йص�����˵����ȷ���ǣ� ��
A. Cu2���ļ۵����Ų�ʽΪ3d84s1
B. ������ԭ�Ӷ���ȡsp3�ӻ�
C. ��ԭ�Ӳ����γ����Ӽ�����λ����������ֻ�ѧ��
D. �����е�ˮ�ڲ�ͬ�¶��»�ֲ�ʧȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ2AB3��g��![]() 2A��g��+3B2��g�� ��H��0������ͼ����ȷ���ǣ� ��
2A��g��+3B2��g�� ��H��0������ͼ����ȷ���ǣ� ��
A. B.
B.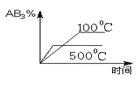
C. D.
D.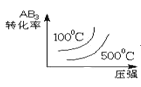
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com