
【题目】(1)在一密闭容器中盛有aL含Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是___。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数___。(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之比___。
③求溶液中ClO-的物质的量___。
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】雕白块(NaHSO2·HCHO·2H2O,易溶于水,呈白色块状固体或结晶性粉状)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产雕白块及氧化锌的工艺流程如下:
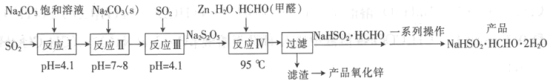
回答下列问题:
(1)NaHSO2·HCHO·2H2O中S元素的化合价为__________。
(2)“反应I”中得到的产物是__________(填化学式)。
(3)设计“反应II”,“反应III”中继续通入SO2的目的是_________。
(4)“反应Ⅳ”的化学方程式为______________。
(5)“过滤”后,“滤渣”是__________(填化学式)。
(6)“一系列操作”包括蒸发浓缩________、________、________干燥。
(7)一种测定雕白块中硫的质量分数的方法如下:称取a g产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为b g。
①雕白块与碘水反应的化学方程式为___________。
②产品中硫的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
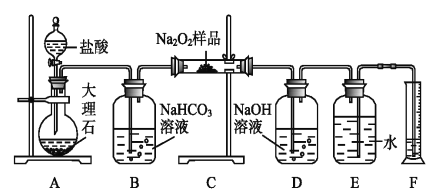
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置的叙述正确的是( )
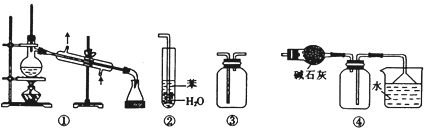
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②用于吸收NH3或HCl气体时,易形成倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3、C2H4等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下框图分析,下列说法正确的是
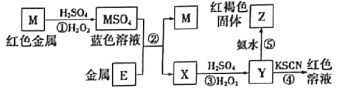
A.E2+的氧化性比M2+的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为E2++3OH-=E(OH)3↓
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO3、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应的还原剂是___,每生成1 mol Na2FeO4,氧化剂得到____mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:____________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:____________。
②低温下,在高铁酸钾溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____(填字母)。
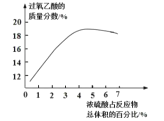
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:![]() )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____(用离子方程式表示)。
(4)滴定时所选指示剂为____;制得过氧乙酸溶液中过氧乙酸质量分数为____%。
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____(填标号)。
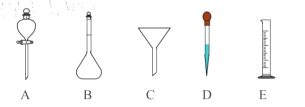
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() X表示原子:
X表示原子:
(1)中性原子的中子数N=______。
(2)AXn+共有x个电子,则该阳离子的中子数N=______。
(3)AXn-共有x个电子,则该阴离子的中子数N=______。
(4)12C16O2分子中的中子数N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com