
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO3、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应的还原剂是___,每生成1 mol Na2FeO4,氧化剂得到____mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:____________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:____________。
②低温下,在高铁酸钾溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明_________。
【答案】FeSO4和Na2O2 5 高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉降 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 低温下,K2FeO4比Na2FeO4的溶解度小
【解析】
(1)①根据方程式可知,铁元素化合价从+2价升高到+6价,失去电子,氧元素化合价从-1价升高到0价,失去电子,降低到-2价,得到电子;
②高铁酸钾中铁处于高价态,具有很强的氧化性;
(2)①根据氧化还原反应的规律书写方程式;
②从K2FeO4溶解度的角度进行判断;
(1)①反应中FeSO4中铁元素失电子,作还原剂,Na2O2中氧元素既失去电子又得到电子既作氧化剂又作还原剂,由方程式可知生成2mol Na2FeO4电子转移10mol,那么每生成1 mol Na2FeO4,氧化剂得到5mol电子;
②高铁酸钾中铁处于高价态,具有很强的氧化性,其还原产物为Fe3+,水解后能生成氢氧化铁胶体,能吸附除去水中的悬浮杂质;
(2)①根据氧化还原反应的规律可知,反应中有化合价的升高和降低,因此反应物为Fe(OH)3、ClO-、OH-,生成物为FeO42-、Cl-、H2O,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②低温下,Na2FeO4的溶解度大于K2FeO4的溶解度。


科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
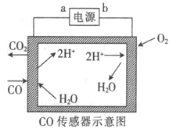
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出化学反应方程式:
(1)在苯酚与水的浊液中加入氢氧化钠溶液后变澄清:_________________;
(2)乙醛与新制备的氢氧化铜反应,产生砖红色沉淀:_________________;
(3)乙醇的催化氧化:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一密闭容器中盛有aL含Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是___。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数___。(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之比___。
③求溶液中ClO-的物质的量___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
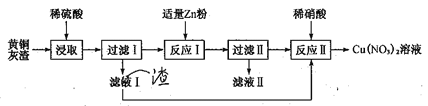
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
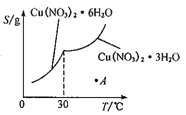
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
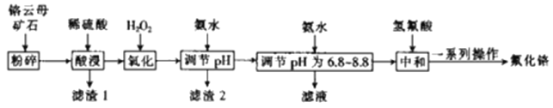
下表列出了相关金属离子生成氢氧化物沉淀的pH:
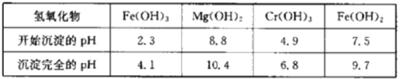
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
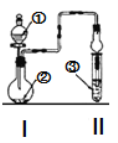
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
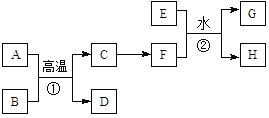
请回答下列问题:
(1)D的化学式是________。
(2)可选用________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____________。
(4)反应②的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com