
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
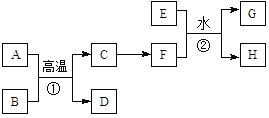
请回答下列问题:
(1)D的化学式是________。
(2)可选用________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____________。
(4)反应②的离子方程式为______________。
【答案】Al2O3 b 2Al+Fe2O3![]() 2Fe + Al2O3 Cu+2Fe3+=Cu2++2Fe2+
2Fe + Al2O3 Cu+2Fe3+=Cu2++2Fe2+
【解析】
A、C、E是常见的金属单质,反应①可用于焊接铁轨,B是赤铁矿的主要成分,则A为Al、B为Fe2O3,C为Fe,D为Al2O3,E是紫红色的金属单质,则E为Cu,F的溶液中加入KSCN溶液变红,F为铁盐,可以由Fe与氯气反应得到,反应②为Cu+2Fe3+=Cu2++2Fe2+。
(1)根据分析,D的化学式是:Al2O3;
(2)反应C→F是Fe转化为Fe3+,Fe与盐酸、CuSO4溶液生成Fe2+,Fe与氯气反应生成FeCl3,故答案选b;
(3)反应①的化学方程式为:2Al+Fe2O3![]() 2Fe + Al2O3;
2Fe + Al2O3;
(4)反应②的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO3、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应的还原剂是___,每生成1 mol Na2FeO4,氧化剂得到____mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:____________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:____________。
②低温下,在高铁酸钾溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知二茂铁(Fe(C5H5)2)熔点是173 ℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5 -与Fe2+之间是以离子键相结合
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() X表示原子:
X表示原子:
(1)中性原子的中子数N=______。
(2)AXn+共有x个电子,则该阳离子的中子数N=______。
(3)AXn-共有x个电子,则该阴离子的中子数N=______。
(4)12C16O2分子中的中子数N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
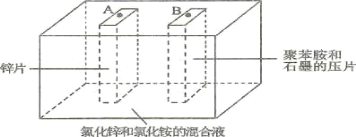
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3 胶体,写出该反应的离子方程式:____________________________。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________。
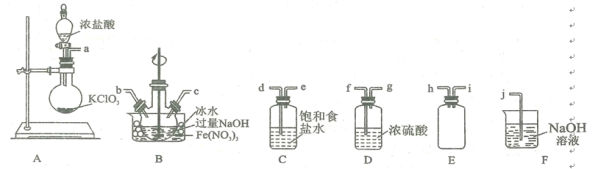
(3)写出装置A中发生的离子方程式: ______________________ 。
(4)三颈烧瓶用冰水浴的原因是 _________________,A处盛放KC1O3的仪器名称 ___________。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42- 形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加人稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com