
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
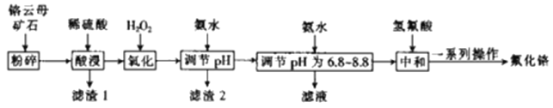
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
【答案】3 增大接触面积,加快反应速率,提高原料的利用率 用于制备光导纤维等 Cr2O3+3H2SO4=Cr2(SO4)3+3H2O 4.1≤pH<4.9 使铬离子完全沉淀,镁离子不沉淀 Cr(OH)3+OH-=CrO2-+2H2O
【解析】
铬云母矿石粉碎的目的是增大接触面积,加快反应速率,提高原料的利用率;稀硫酸酸浸时二氧化硅与硫酸不反应,滤渣1的成分为二氧化硅;加入过氧化氢的主要目的是将亚铁离子氧化为铁离子,加氨水调节pH的目的是除去铁离子,调节pH为6.8—8.8的目的是使铬离子转化为氢氧化铬沉淀。
(1)碱性氧化物指的是与酸反应只产生盐和水的氧化物,因此Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有Fe2O3、MgO、FeO,故有3种;
(2)将铬云母矿石粉碎的目的是增大接触面积,加快反应速率,提高原料的利用率;
(3)滤渣1的主要成分为二氧化硅,其用途为制造玻璃、光导纤维等;
(4)氧化铬与硫酸反应产生硫酸铬和水,对应的化学方程式为:Cr2O3+3H2SO4=Cr2(SO4)3+3H2O;
(5)第一次调节pH的目的是除去铁离子,保证铬离子不沉淀,因此第一次滴加氨水调节pH范围为4.1≤pH<4.9;
(6)第二次滴加氨水调节pH为6.8~8.8的目的是使铬离子转化为氢氧化铬沉淀,由于氢氧化铬的性质类似与氢氧化铝,因此氢氧化铬与氢氧化钠溶液反应的离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是( )
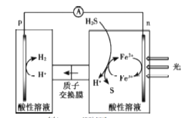
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
B.1L0.1molL-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C.0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D.2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应3A(g)+B(s)![]() 2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C. 增加A的浓度,平衡向正方向移动,平衡常数增大
D. 增加B的用量,正、逆反应速率不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
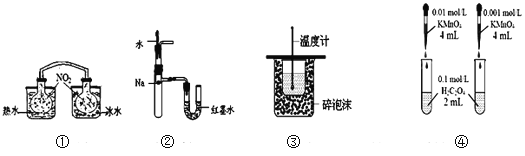
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写有关空白)
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂___(填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)用___(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的___(填部位),右手摇动锥形瓶,眼睛注视___,直到滴定终点。滴定至终点时的现象是___。
(五)数据记录与处理(请在下面设计并画出数据记录和数据处理的表格,不必填数据)。__

若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是___mg/L。
(六)问题讨论:
(1)滴定时能否剧烈摇动锥形瓶?为什么?_____
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?___(填“是”或“不是”或“可能是”)。制造商最可能采取的做法是____(填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
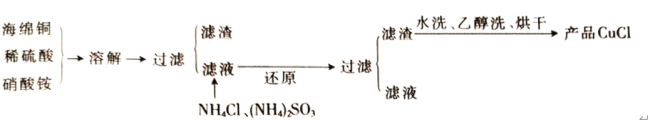
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________(填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的实验。已知氯气在加热条件下与氢氧化钾反应生成氯酸钾、水和氯化钾。
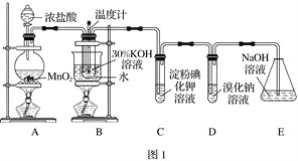
(1)A装置中反应的离子方程式为_______,B装置中反应的离子方程式为_______,B装置采用水浴加热的优点是_______。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。
(3)验证非金属性:Cl>I的实验现象是_______,该装置______(填“能”或“不能”)验证非金属性:Cl>Br>I。
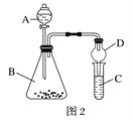
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入_____,C中反应的化学方程式:_____,D装置的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com