
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硼及其化合物在食品、纺织、医药、航空等领域应用广泛。
(1)砷化镓是一种重要的半导体材料。镓(Ga)与硼同族,镓的原子结构示意图为____。
(2)B2H6(乙硼烷)气体燃烧热值高,是未来的高能燃料,用于火箭和导弹。1molB2H6(g)在O2(g)中燃烧,生成B2O3(s)和H2O(g)放出2033.8kJ的热量,写出该反应的热化学方程式__________。
(3)在其他条件相同时,反应H3BO3+3CH3OH![]() B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
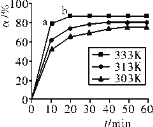
①该反应的△H_______0(填“<”=”或“>”)。分析H3BO3的速率,va(逆)_______vb(正))(填“<”“=”或“>”)。
②根据化学反应原理,分析升高温度对制备B(OCH3)3反应的影响_______。
③若要进一步提高硼酸的转化率,除了可以适当改变反应温度外,还可以采取的措施有:_______。
(4)H3BO3溶液中存在如下反应:H3BO3(aq) +H2O(l)=[B(OH)4]-(aq)+H+(aq)。常温时,已知0.70molL-1H3BO3溶液中,平衡(H+)=2.0×10-5molL-1,水的电离可忽略不计,列式计算该反应的平衡常数K约为_______(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
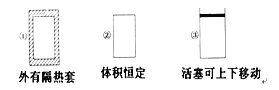
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
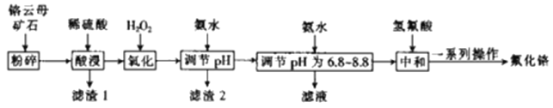
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
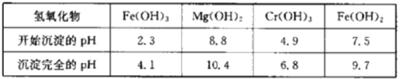
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A.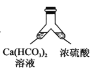 B.
B.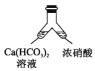 C.
C.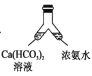 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
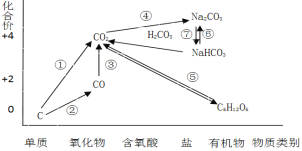
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
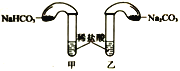
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2![]() Na2O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):
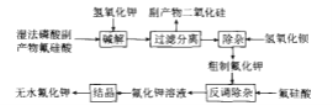
请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。
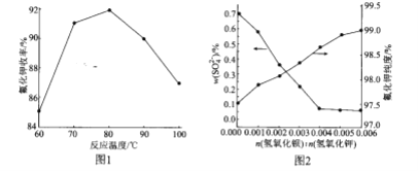
(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com