
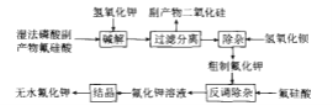
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):
请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。
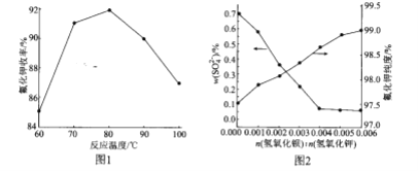
(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
【答案】![]()
![]() 80℃ 温度过高时,
80℃ 温度过高时,![]() 易分解为SiF4和HF 除硫过程中,Ba2+能与KF溶液中少量的
易分解为SiF4和HF 除硫过程中,Ba2+能与KF溶液中少量的![]() 反应生成沉淀 0.022 =
反应生成沉淀 0.022 = ![]()
【解析】
通过湿法磷酸副产物氟硅酸制备氟化钾的过程中,碱解过程主要发生的反应为氟硅酸与氢氧化钾的反应,生成二氧化硅及酸碱中和反应的盐![]() ,其中
,其中![]() 为目标产物,硅酸钾则为需要除去的杂质。为了减少
为目标产物,硅酸钾则为需要除去的杂质。为了减少![]() 的量,需要控制氢氧化钾的用量。通过过滤除去二氧化硅等不溶物,再加入氢氧化钡除去
的量,需要控制氢氧化钾的用量。通过过滤除去二氧化硅等不溶物,再加入氢氧化钡除去![]() 和少量的
和少量的![]() ,即可获得粗制的
,即可获得粗制的![]() ,据此答题。
,据此答题。
(1)碱解过程主要发生的反应为氟硅酸与氢氧化钾的反应,会生成二氧化硅及酸碱中和反应的盐![]() ,故该反应方程式可写为
,故该反应方程式可写为![]() 。该反应要严格控制KOH用量,否则易使
。该反应要严格控制KOH用量,否则易使![]() 溶解,产生更多的副产物
溶解,产生更多的副产物![]() ,故答案为
,故答案为![]() 、
、![]() ;
;
(2)从图中可知80℃时,氟化钾收率最高,故实验选择适宜的反应温度为80℃;但由于温度过高时,![]() 易分解为SiF4和HF,所以在80℃最高点后,随温度升高曲线下降,故答案应为80℃、温度过高时,
易分解为SiF4和HF,所以在80℃最高点后,随温度升高曲线下降,故答案应为80℃、温度过高时,![]() 易分解为SiF4和HF;
易分解为SiF4和HF;
(3)由于在除硫过程中,Ba2+能与KF溶液中少量的![]() 反应生成沉淀,所以当
反应生成沉淀,所以当![]() 由0.004到0.005时,氟化钾的纯度升高,故答案应为Ba2+能与KF溶液中少量的
由0.004到0.005时,氟化钾的纯度升高,故答案应为Ba2+能与KF溶液中少量的![]() 反应生成沉淀;
反应生成沉淀;
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() =
=![]() = 0.022,故答案应为0.022;
= 0.022,故答案应为0.022;
(5)浓度均为0.1mol/L的KF和HF的混合溶液中存在电荷守恒关系为: c(![]() )+ c(
)+ c(![]() ) =c(
) =c(![]() )+c(
)+c(![]() );物料守恒关系为:2c(
);物料守恒关系为:2c(![]() )= c(
)= c(![]() )+ c(HF) 。将物料守恒中c(
)+ c(HF) 。将物料守恒中c(![]() ) 代入电荷守恒中,即可得到2c(
) 代入电荷守恒中,即可得到2c(![]() )-2c(
)-2c(![]() )=c(
)=c(![]() )-c(HF),故答案为:=;
)-c(HF),故答案为:=;
(6)KMnO4和KF、HF混合溶液反应可生成稳定配离子![]() ,该反应氧化产物为氧气,则根据氧化还原反应对该反应的离子方程式进行配平为
,该反应氧化产物为氧气,则根据氧化还原反应对该反应的离子方程式进行配平为![]() ,故答案为
,故答案为![]()


科目:高中化学 来源: 题型:
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
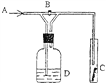
A. 浓H2SO4 B. 浓NaOH溶液
C. 饱和Na2SO4溶液 D. 石灰乳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
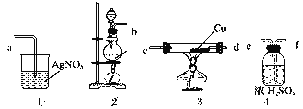
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__。
(2)实验室制备Cl2的离子方程式为___。
(3)装置③中Cu的作用___(用化学方程式表示)。
(4)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__。
a.淀粉-KI溶液 b.品红溶液 c.氢氧化钠溶液 d.湿润的淀粉-KI试纸
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__的现象,则证明制Cl2时有HCl挥发出来。
(6)实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的实验。已知氯气在加热条件下与氢氧化钾反应生成氯酸钾、水和氯化钾。
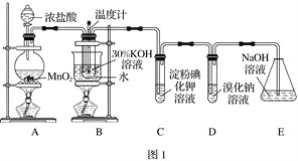
(1)A装置中反应的离子方程式为_______,B装置中反应的离子方程式为_______,B装置采用水浴加热的优点是_______。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。
(3)验证非金属性:Cl>I的实验现象是_______,该装置______(填“能”或“不能”)验证非金属性:Cl>Br>I。
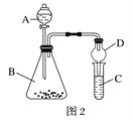
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入_____,C中反应的化学方程式:_____,D装置的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:
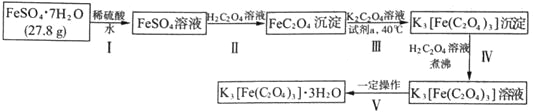
回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
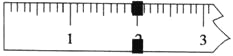
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。
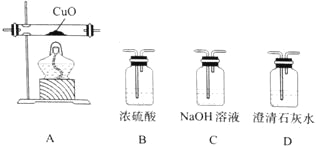
按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
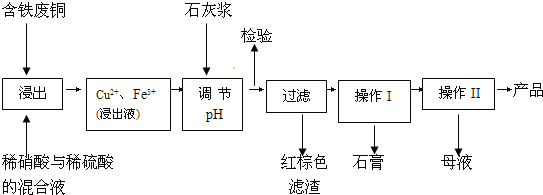
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。

请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________。
(4)装置D的作用是___________________________。
(5)读取N2的体积时,应注意
①______________________
②______________________
③______________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com