
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是( )
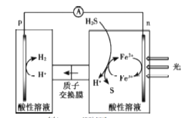
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
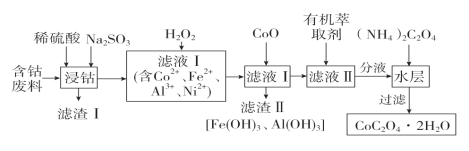
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
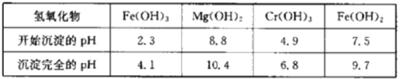
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有酚酞的NaOH溶液中,逐滴滴入新制氯水,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,试回答下列问题:
(1)新制氯水成分:__________________________________________________。
(2)请用简要的文字说明溶液红色褪去的原因可能有两种
①___________________________________________________________________________。
②___________________________________________________________________________。
(3)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
a.取试管内的无色溶液3mL盛于另一支洁净的试管中;
b.__________________________________________________________,振荡试管,
(实验现象及结论)
Ⅰ若________________________,则证明溶液红色褪去的原因是①而不是②;
Ⅱ若________________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在食品、纺织、医药、航空等领域应用广泛。
(1)砷化镓是一种重要的半导体材料。镓(Ga)与硼同族,镓的原子结构示意图为____。
(2)B2H6(乙硼烷)气体燃烧热值高,是未来的高能燃料,用于火箭和导弹。1molB2H6(g)在O2(g)中燃烧,生成B2O3(s)和H2O(g)放出2033.8kJ的热量,写出该反应的热化学方程式__________。
(3)在其他条件相同时,反应H3BO3+3CH3OH![]() B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
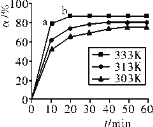
①该反应的△H_______0(填“<”=”或“>”)。分析H3BO3的速率,va(逆)_______vb(正))(填“<”“=”或“>”)。
②根据化学反应原理,分析升高温度对制备B(OCH3)3反应的影响_______。
③若要进一步提高硼酸的转化率,除了可以适当改变反应温度外,还可以采取的措施有:_______。
(4)H3BO3溶液中存在如下反应:H3BO3(aq) +H2O(l)=[B(OH)4]-(aq)+H+(aq)。常温时,已知0.70molL-1H3BO3溶液中,平衡(H+)=2.0×10-5molL-1,水的电离可忽略不计,列式计算该反应的平衡常数K约为_______(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
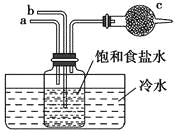
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
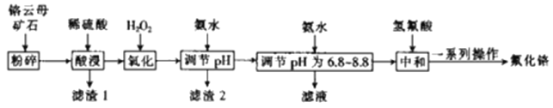
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com