
����Ŀ���ú��ܷ���(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��NiO��SiO2��)�Ʊ������ܾ���(CoC2O4��2H2O)��������ͼ��
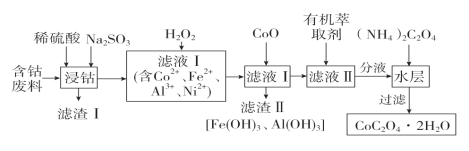
(1)�������ijɷ���________������ʱAl2O3�ܽ�����ӷ���ʽΪ__________________��Co2O3�ܽ�����ӷ���ʽΪ________________________________��
(2)��Һ������H2O2��Ŀ����________________________________________������CoO����Fe(OH)3��Al(OH)3��ԭ����_________________________________________����Ҫ����Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������_____________��(��֪����Һ������Ũ��С��1��10��5 mol��L��1������Ϊ������ȫ������Ni(OH)2��Fe(OH)3��Al(OH)3��Ksp�ֱ�Ϊ1��10��15��1��10��38��1��10��32)
(3)�����л���ȡ����Ŀ����_______________________________��
(4)����(NH4)2C2O4��Ӧ�����ӷ���ʽΪ___________________________________��
���𰸡�SiO2 Al2O3+6H+=2 Al3++3H2O Co2O3+SO32-+4H+= 2Co2++ SO32-+2H2O ��Fe2+����ΪFe3+���Ա���������������������ȥ CoO�������ӷ�Ӧ������������Ũ�ȣ���ʹFe3+��Al3+��ˮ��ƽ�������ƶ����Ӷ�����Fe(OH)3��Al(OH)3���� �ܽ�Ni 2����ʹ֮��ˮ����� 5<pH<9 Co2++ C2O42-+2H2O=CoC2O4��2H2O��
��������
���ܷ��ϣ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��NiO��SiO2��������ϡ������������ƣ�Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�CoSO4��FeSO4��Al2(SO4)3��NiSO4��Һ��SiO2�����������Һ�м���H2O2����Fe2+����ΪFe3+������CoO��pH���ɵõ�Fe��OH��3��Al��OH��3���������˺�������Һ��Ҫ����CoSO4��Ni SO4�������л���ȡ������Һ��ˮ������Ҫ����CoSO4������������Һ�õ������ܣ��ݴ˷������
(1) ���ܷ�����ֻ��SiO2�������ᷴӦ���������ijɷ���SiO2������ʱAl2O3�����ᷴӦ������������ˮ��Al2O3�ܽ�����ӷ���ʽΪAl2O3+6H+=2 Al3++3H2O��Co2O3�ܽ�ʱNa2SO3��Co3+��ԭΪCo2+����Ӧ�����ӷ���ʽΪCo2O3+SO32-+4H+= 2Co2++ SO32-+2H2O��
(2)��Һ������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+���Ա���������������������ȥ������CoO�������ӷ�Ӧ������������Ũ�ȣ���ʹFe3+��Al3+��ˮ��ƽ�������ƶ����Ӷ�����Fe(OH)3��Al(OH)3��������Fe3��ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>3����Al3+ȫ������ʱ��c(OH-)>
����ʱ��Һ��pH>3����Al3+ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>5����Ni 2��ȫ������ʱ��c(OH-)>
����ʱ��Һ��pH>5����Ni 2��ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>9������Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������5<pH<9��
����ʱ��Һ��pH>9������Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������5<pH<9��
(3)�����л���ȡ����Ŀ������ȡNi 2����ʹ֮��ˮ����롣
(4)����(NH4)2C2O4����CoC2O4��H2O��������Ӧ�����ӷ���ʽ��Co2++ C2O42-+2H2O=CoC2O4��2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����������ǣ�������
A.�ƹ�ʹ������ϴ�·���Ҫ��Ϊ�˷�ֹˮ�帻Ӫ����
B.�������![]() ��һ����������ˮ����������ǿ�����Կ�����ɱ�����仹ԭ����������ˮ������
��һ����������ˮ����������ǿ�����Կ�����ɱ�����仹ԭ����������ˮ������
C.ʯ���ѽ⡢ú����������ˮ��þ����ά���ƻ��ȹ����ж�������ѧ�仯
D.�ⶨ�л���ṹ�����϶࣬�������ס�������ס����ס��˴Ź������ס�ͬλ��ԭ��ʾ�ٷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25�桢101kPa�£�1g�״�ȼ������CO2��Һ̬ˮʱ����22.68kJ�����б�ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ��ȷ���ǣ�������
A. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ��H=+725.8 kJ��mol��1
O2(g)=CO2(g)+2H2O(l) ��H=+725.8 kJ��mol��1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ��H=-1452 kJ��mol��1
C. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ��H=-725.8 kJ��mol��1
O2(g)=CO2(g)+2H2O(l) ��H=-725.8 kJ��mol��1
D. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ��H=+1 452 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ����ƽ���ƶ�ԭ�������͵���
�����ڳ�ʪ�Ŀ�������������
����������������������ƽ����ϵ����ѹ��С�������ɫ����
��ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ�����
�������Ȼ��ع����Ʊ��� Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
������ơ��ƿ��ƿ�����Ϸ��������ĭ
A. �ۢ� B. �٢� C. �٢� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ü״�����ϩ����ϩ��ϩ��ʱ�����¶�Ϊ400 ��ʱ������������ӦΪ2CH3OH![]() C2H4+2H2O��3CH3OH
C2H4+2H2O��3CH3OH![]() C3H6+3H2O������ӦΪ2CH3OH
C3H6+3H2O������ӦΪ2CH3OH![]() CH3OCH3+H2O����ϩ�ͱ�ϩ��ѡ����(ת���ļ״���������ϩ�ͱ�ϩ�İٷֱ�)����ϩ����ϩ�ı�ֵ(Cat.1��Cat.2�������ֵ����Ĵ���)��ͼ��ʾ������˵������ȷ����
CH3OCH3+H2O����ϩ�ͱ�ϩ��ѡ����(ת���ļ״���������ϩ�ͱ�ϩ�İٷֱ�)����ϩ����ϩ�ı�ֵ(Cat.1��Cat.2�������ֵ����Ĵ���)��ͼ��ʾ������˵������ȷ����
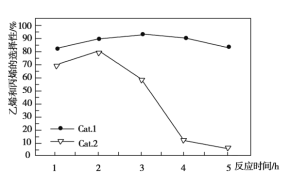
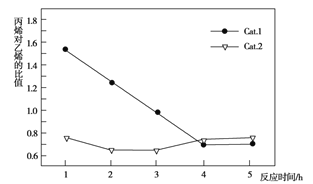
A. ʹ��Cat.2��Ӧ2Сʱ����ϩ�ͱ�ϩ��ѡ�����½�
B. ʹ��Cat.1��Ӧ3Сʱ�������ϩ����Ҫ����ϩ
C. ʹ��Cat.2��Ӧ3Сʱ�ڲ�����ϩ����Ҫ�DZ�ϩ
D. ʹ��Cat.1ʱ��ϩ�ͱ�ϩ��ѡ����һֱ����ʹ��Cat.2ʱ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH�T2K2CO3+6H2O
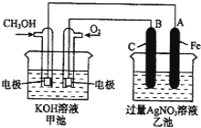
��1����ش�ͼ�мס������ص����ƣ��׳��� ______װ�ã��ҳ��� ______ װ�ã�
��2����ش����е缫�����ƣ�ͨ��CH3OH�ĵ缫������ ______ ��B��ʯī���缫�������� ______ ��
��3��ͨ��O2�ĵ缫�ĵ缫��ӦʽΪ�� ______ ��A ��Fe���缫�ĵ缫��ӦʽΪ ______ ��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ ______ ��
��5�����һ��ʱ����ҳ���A��Fe��������������5.4gʱ������Һ�����Ϊ500mL����������Һ��25��ʱ��pH= ______ ���׳�������O2Ϊ ______ mL����״���£���
��6���������壨CoFe2O4����������Ҫ�Ĵ��Բ��ϡ������������ϣ�������Ҫ������ӵ�ظ������ϡ���ҵ�ϣ��õ绯ѧ���Ƶ�CoFe2O4����NaOH��Һ�����Һ�������������Ͻ�CoFe2�����������е�⣬�������ϻ��CoFe2O4��Ĥ���õ����̵Ļ�ѧ����ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.0gþ��������ȼ�պ�����0.64g, ���ڿ�����ȼ��ʱ���ز���0.64g����ԭ�������
A. ������þȼ�տ϶�����ȫ B. �����в���þ��CO2��Ӧ
C. ������þ������N2��Ӧ D. ������þ������ˮ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2Sת��Ϊ�������õ���Դ����Դ�о��������Ҫ���⡣ijת������ԭ����ͼ����װ�ù���ʱ����������������ǣ� ��
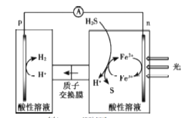
A.p�缫�ĵ缫��Ӧ��2H++2e-=H2
B.�÷�����ʵ����H2S��Ч����S��H2
C.���պ�n�缫�ĵ缫��Ӧ��H2S-2e-=2H++S
D.����Fe3+/Fe2+�⣬I3-/I-Ҳ��ʵ����ͼ��ʾѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NAΪ�����ӵ�������ֵ������˵����ȷ����
A.3g��CO2��SO2��ɵĻ�������к��е�������Ϊ1.5NA
B.1L0.1molL��1 Na2SiO3��Һ�к��е�SiO32-��ĿΪ0.1NA
C.0.1molH2O2�ֽ����O2ʱ��ת�Ƶĵ�����Ϊ0.2NA
D.2.8g����ϩ�к��е�̼̼˫����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com