
【题目】已知用甲醇制乙烯、丙烯等烯烃时,在温度为400 ℃时,发生的主反应为2CH3OH![]() C2H4+2H2O、3CH3OH
C2H4+2H2O、3CH3OH![]() C3H6+3H2O,副反应为2CH3OH
C3H6+3H2O,副反应为2CH3OH![]() CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是
CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是
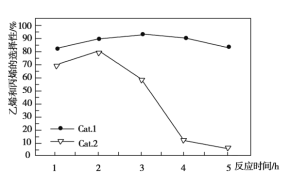
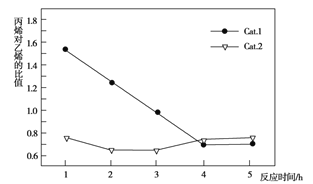
A. 使用Cat.2反应2小时后乙烯和丙烯的选择性下降
B. 使用Cat.1反应3小时后产生的烯烃主要是乙烯
C. 使用Cat.2反应3小时内产生的烯烃主要是丙烯
D. 使用Cat.1时乙烯和丙烯的选择性一直高于使用Cat.2时
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如下图:
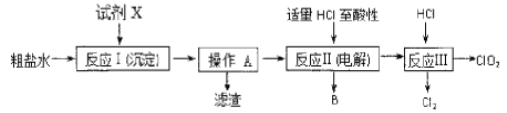
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________。
②上述步骤3中滴定终点的现象是__________________________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-10-羟基-2-癸烯酸(HO![]() COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
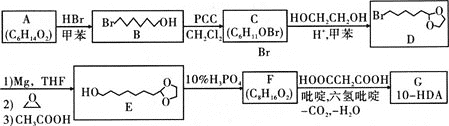
已知:1mol A与足量金属钠反应生成1mol H2;C、F都能发生银镜反应
回答下列问题:
(1)A的化学名称为________;A生成B的反应类型为________;D的分子式为________;F的结构简式为________。
(2)若用金属铜催化氧化B生成C,其化学方程式为________。
(3)由C→D、E→F的转化,可推断此设计的目的是________。
(4)G的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构);
①能与饱和碳酸氢钠溶液反应产生气体
②含六元环醚结构和正丁基(-CH2CH2CH2CH3)
其中核磁共振氢谱显示为7组峰的是________(写结构简式)。
(5)G与酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
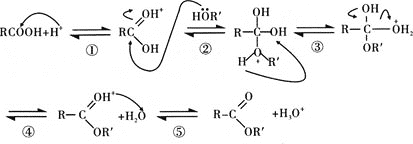
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯的反应历程:_______
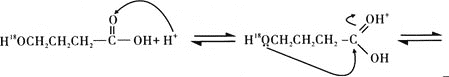
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究氯气的性质,某同学设计了如图1所示的实验装置。
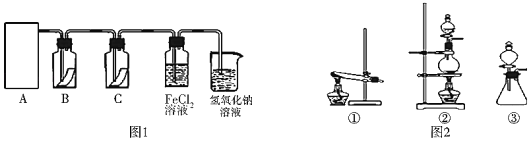
(1)实验中制取氯气的反应原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,该反应中还原剂是_____,还原产物是_____
MnCl2+Cl2↑+2H2O,该反应中还原剂是_____,还原产物是_____
(2)利用(1)中制气原理,从图2中选择合适的制气装置(A处):_____(填写序号)。
(3)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条退色,但实验过程中该同学发现装置B、C中的布条均退色,其原因可能是_____,说明该装置存在明显的缺陷,请提出合理的改进方法_____
(4)为了验证氯气的氧化性,将氯气通入FeCl2溶液中,写出氯气与FeCl2溶液反应的离子方程式_____
(5)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
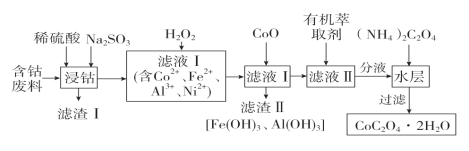
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有酚酞的NaOH溶液中,逐滴滴入新制氯水,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,试回答下列问题:
(1)新制氯水成分:__________________________________________________。
(2)请用简要的文字说明溶液红色褪去的原因可能有两种
①___________________________________________________________________________。
②___________________________________________________________________________。
(3)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
a.取试管内的无色溶液3mL盛于另一支洁净的试管中;
b.__________________________________________________________,振荡试管,
(实验现象及结论)
Ⅰ若________________________,则证明溶液红色褪去的原因是①而不是②;
Ⅱ若________________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com