
【题目】1.0g镁在氧气中燃烧后增重0.64g, 但在空气中燃烧时增重不足0.64g,其原因可能是
A. 空气中镁燃烧肯定不完全 B. 空气中部分镁与CO2反应
C. 空气中镁部分与N2反应 D. 空气中镁部分与水蒸气反应
【答案】C
【解析】
A、镁是活泼金属,在空气中能完全燃烧,故A错误;B、2Mg+CO2![]() 2MgO+C,2molMg增重16g×2+12g=44g,2Mg + O2
2MgO+C,2molMg增重16g×2+12g=44g,2Mg + O2 ![]() 2MgO,2molMg增重16g×2=32g,同质量的镁与CO2反应增重更大,故B错误。C、3Mg + N2
2MgO,2molMg增重16g×2=32g,同质量的镁与CO2反应增重更大,故B错误。C、3Mg + N2 ![]() Mg3N2
Mg3N2
,3molMg与N2反应增重14g×2=28g,3molMg与O2增重16g×3=48g,同质量的镁与O2反应增重更大,故C正确。D、Mg+2H2O![]() Mg(OH)2+H2↑,1molMg与O2增重16g,1molMg与H2O增重17g×2=34g,同质量的镁与水蒸气反应固体增重更大,故D错误。故选C。
Mg(OH)2+H2↑,1molMg与O2增重16g,1molMg与H2O增重17g×2=34g,同质量的镁与水蒸气反应固体增重更大,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1等病毒,某同学昀买了 一瓶“84消毒液”,并査阅相关资料和消毒液包装说明得到 如下信息:“84消毒液”含25%NaC10、1000 mL、密度 1. 192 g/cm 3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”中NaClO的物质的量浓度为________ mol/L。
(2)该同学取100 mL稀释后的消毒液用于消毒,稀释后溶液中 c(Na+)为_______mol/L。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含4. 0 mol/L NaClO的消毒液。下列说法正确的是________(填序号)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.利用购买的商品NaClO来配制,可能导致结果偏低
C.需要称量NaClO固体的质量为143. 0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
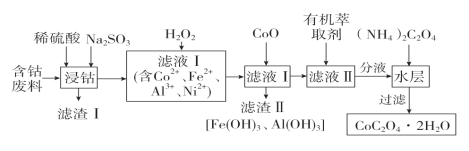
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有酚酞的NaOH溶液中,逐滴滴入新制氯水,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,试回答下列问题:
(1)新制氯水成分:__________________________________________________。
(2)请用简要的文字说明溶液红色褪去的原因可能有两种
①___________________________________________________________________________。
②___________________________________________________________________________。
(3)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
a.取试管内的无色溶液3mL盛于另一支洁净的试管中;
b.__________________________________________________________,振荡试管,
(实验现象及结论)
Ⅰ若________________________,则证明溶液红色褪去的原因是①而不是②;
Ⅱ若________________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com