
【题目】“84消毒液”能有效杀灭甲型H1N1等病毒,某同学昀买了 一瓶“84消毒液”,并査阅相关资料和消毒液包装说明得到 如下信息:“84消毒液”含25%NaC10、1000 mL、密度 1. 192 g/cm 3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”中NaClO的物质的量浓度为________ mol/L。
(2)该同学取100 mL稀释后的消毒液用于消毒,稀释后溶液中 c(Na+)为_______mol/L。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含4. 0 mol/L NaClO的消毒液。下列说法正确的是________(填序号)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.利用购买的商品NaClO来配制,可能导致结果偏低
C.需要称量NaClO固体的质量为143. 0 g
【答案】4.0 0.04 B
【解析】
(1)该溶液的物质的量浓度=![]() ;
;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的百分之一,根据钠原子守恒计算稀释后钠离子浓度;
(3)A.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干;
B.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少;
C.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,根据m=cVM计算次氯酸钠质量;
(1)该溶液的物质的量浓度=![]() =
=![]() mol·L-1=4.0mol·L-1;
mol·L-1=4.0mol·L-1;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的百分之一,根据钠原子守恒计算稀释后钠离子浓度,为0.04mol·L-1,根据钠原子守恒得c(Na+)=c(NaClO)=0.04mol·L-1;
(3)A.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干,因为留有的少量水不影响溶液配制,故A错误;
B.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故B正确;
C.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g,故C错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是( )
A.推广使用无磷洗衣粉主要是为了防止水体富营养化
B.高铁酸钾![]() 是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质
是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质
C.石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化
D.测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
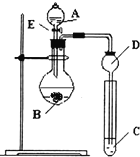
(1)图中D装置名称是______.
(2)N、C、Si的非金属性由强到弱的顺序是:______;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为______;试剂C为______(填序号).
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3)①乙同学设计的实验所用到试剂A为______;试剂B为______;试剂C为______.(写名称)
②写出C中发生反应的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
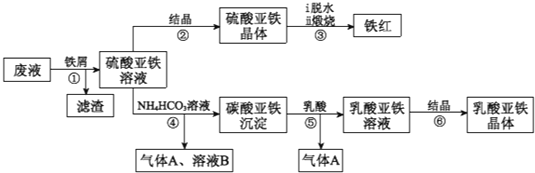
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S)![]() Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
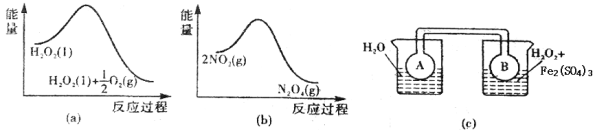
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A. v(A)=0.15molL﹣1s﹣1B. v(B)=0.6molL﹣1s﹣1
C. v(C)=0.5molL﹣1s﹣1D. v(D)=0.4molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列表示甲醇燃烧热的热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+725.8 kJ·mol﹣1
O2(g)=CO2(g)+2H2O(l) △H=+725.8 kJ·mol﹣1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol﹣1
C. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol﹣1
O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol﹣1
D. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=+1 452 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.0g镁在氧气中燃烧后增重0.64g, 但在空气中燃烧时增重不足0.64g,其原因可能是
A. 空气中镁燃烧肯定不完全 B. 空气中部分镁与CO2反应
C. 空气中镁部分与N2反应 D. 空气中镁部分与水蒸气反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com