
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
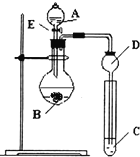
(1)图中D装置名称是______.
(2)N、C、Si的非金属性由强到弱的顺序是:______;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为______;试剂C为______(填序号).
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3)①乙同学设计的实验所用到试剂A为______;试剂B为______;试剂C为______.(写名称)
②写出C中发生反应的化学方程式______.
【答案】长颈漏斗 N、C、Si ① ④ 双氧水 二氧化锰 氢硫酸或硫化钠溶液 2H2S+O2=2S↓+2H2O
【解析】
(1)根据装置图分析;
(2)根据同周期和同主族元素非金属性的变化规律分析;通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸依此选择试剂;
(3)通过比较单质的氧化性来判断非金属性。
(1)由装置图可知,A为加液装置,A为分液漏斗,故答案为:长颈漏斗;
(2)同周期从左到右非金属性增强,则C<N,同主族元素从上到下非金属性:C>Si,所以非金属性由强到弱的顺序是:N>C>Si;通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,故答案为:N、C、Si; ①;④;
(3)①完成了O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单质,故答案为:双氧水; 二氧化锰; 氢硫酸或硫化钠溶液;
②C中发生反应的方程式为:2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O。


科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
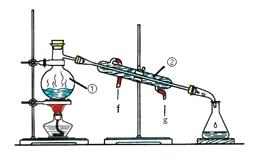
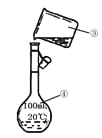
I II
(1)写出上述图中仪器的名称:①_______;②______;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为_____;实验时仪器②中冷却水的进口为_______(选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是_______,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:

下列叙述正确的是
A. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. Na2CO3溶液不能与次氯酸发生反应
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-= CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如下图:
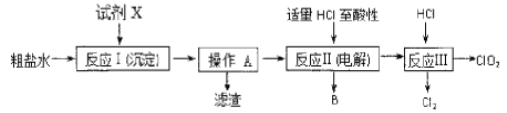
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________。
②上述步骤3中滴定终点的现象是__________________________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·H2O2),俗名固体双氧水,具有Na2CO3和H2O2双重性质,可用作无毒漂白剂和供氧剂。一种利用双氧水和纯碱在稳定剂作用下制备过碳酸钠的工艺流稳定程如下图。已知:2Na2CO3+3H2O2![]() 2Na2CO3·3H2O2
2Na2CO3·3H2O2

下列说法不正确的是
A.FeCl3溶液可加速过碳酸钠的失效
B.加入NaCl的作用是降低2Na2CO3·3H2O2的溶解度,以析出更多晶体
C.生产过碳酸钠的流程中遗漏了晶体的洗涤一步,导致产品纯度降低
D.该生产流程中可循环使用的物质是CO2和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1等病毒,某同学昀买了 一瓶“84消毒液”,并査阅相关资料和消毒液包装说明得到 如下信息:“84消毒液”含25%NaC10、1000 mL、密度 1. 192 g/cm 3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”中NaClO的物质的量浓度为________ mol/L。
(2)该同学取100 mL稀释后的消毒液用于消毒,稀释后溶液中 c(Na+)为_______mol/L。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含4. 0 mol/L NaClO的消毒液。下列说法正确的是________(填序号)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.利用购买的商品NaClO来配制,可能导致结果偏低
C.需要称量NaClO固体的质量为143. 0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于氧化还原反应但不属于四种基本反应类型的是
A.4Fe(OH)2+O2+2H2O =4Fe(OH)3
B.Cl2+ H2O![]() HCl+ HClO
HCl+ HClO
C.NaHCO3+HCl=NaCl+H2O + CO2↑
D.C+H2O = CO↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-10-羟基-2-癸烯酸(HO![]() COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
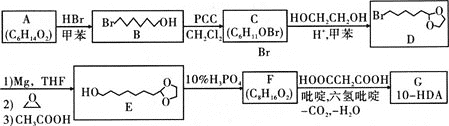
已知:1mol A与足量金属钠反应生成1mol H2;C、F都能发生银镜反应
回答下列问题:
(1)A的化学名称为________;A生成B的反应类型为________;D的分子式为________;F的结构简式为________。
(2)若用金属铜催化氧化B生成C,其化学方程式为________。
(3)由C→D、E→F的转化,可推断此设计的目的是________。
(4)G的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构);
①能与饱和碳酸氢钠溶液反应产生气体
②含六元环醚结构和正丁基(-CH2CH2CH2CH3)
其中核磁共振氢谱显示为7组峰的是________(写结构简式)。
(5)G与酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
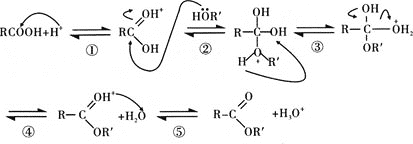
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯的反应历程:_______
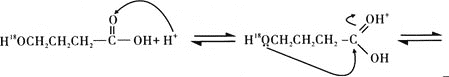
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com