
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
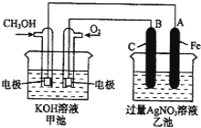
(1)请回答图中甲、乙两池的名称.甲池是 ______装置,乙池是 ______ 装置;
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ______ ,B(石墨)电极的名称是 ______ ;
(3)通入O2的电极的电极反应式为: ______ ,A (Fe)电极的电极反应式为 ______ ;
(4)乙池中反应的化学方程式为 ______ ;
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH= ______ ,甲池中消耗O2为 ______ mL(标准状况下).
(6)钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,用电化学法制得CoFe2O4。以NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
【答案】原电池 电解池 负极 阳极 O2+2H2O+4e-=4OH- 4Ag++4e-=4Ag 4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3 1 280 CoFe2+4H2O
4Ag+O2↑+4HNO3 1 280 CoFe2+4H2O![]() CoFe2O4+4 H2↑
CoFe2O4+4 H2↑
【解析】
根据反应方程式知,甲是把化学能转变为电能的装置;乙有外加电源,所以是电解池;根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以B(石墨)电极是阳极,A (Fe)极与负极相连,A是阴极。
(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,甲是原电池;乙有外加电源,所以乙是电解池;
(2)CH3OH发生氧化反应,通入CH3OH的电极名称是负极,石墨与原电池的正极相连,所以B(石墨)电极的名称是阳极;
(3)O2 得电子发生还原反应,所以该电极是正极,通入O2的电极反应式为: O2+2H2O+4e-=4OH-,A (Fe)极与负极相连,A是阴极,A (Fe)电极的电极反应式为 4Ag++4e-=4Ag;
(4)乙是电解池,阳极氢氧根离子失电子生成氧气,阴极银离子得电子生成单质银,总反应的化学方程式为4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(5)乙池中A(Fe)极是阴极,阴极的质量增加的5.40g是银,根据得失电子数相等,氧气、氢离子与银的关系式为O2--------4Ag-------4H+ ;设消耗氧气的体积是xL,生成氢离子的物质的量为ymol;
O2--------4Ag-------4H+
22.4L ( 4×108 )g 4mol
xL 5.40g ymol
![]() 、
、![]()
x=0.28L=280mL;y=0.05mol;
溶液的体积为500mL,![]() ,所得溶液在25℃时的pH=1。
,所得溶液在25℃时的pH=1。
(6)以NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,阳极上CoFe2失电子生成CoFe2O4薄膜,阴极氢离子得电子生成氢气,该电解过程的化学方程式为CoFe2+4H2O![]() CoFe2O4+4 H2↑。
CoFe2O4+4 H2↑。


科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
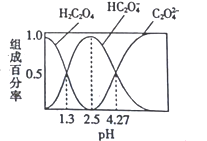
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对古文献记载内容理解错误的是
A. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。
B. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏。
C. 《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还成丹砂”。该过程未发生氧化还原反应。
D. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
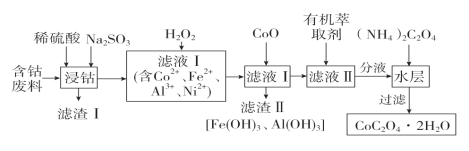
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应和反应类型不相符的是
A. 苯与浓硝酸、浓硫酸混合加热制取硝基苯(取代反应)
B. 在一定条件下,苯与氯气生成六氯环己烷(加成反应)
C. 由乙炔(![]() )制取氯乙烯(CH2=CHCl) (氧化反应)
)制取氯乙烯(CH2=CHCl) (氧化反应)
D. 在催化剂的作用下由乙烯制取氯乙烷(加成反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在食品、纺织、医药、航空等领域应用广泛。
(1)砷化镓是一种重要的半导体材料。镓(Ga)与硼同族,镓的原子结构示意图为____。
(2)B2H6(乙硼烷)气体燃烧热值高,是未来的高能燃料,用于火箭和导弹。1molB2H6(g)在O2(g)中燃烧,生成B2O3(s)和H2O(g)放出2033.8kJ的热量,写出该反应的热化学方程式__________。
(3)在其他条件相同时,反应H3BO3+3CH3OH![]() B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
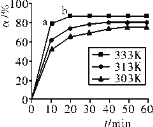
①该反应的△H_______0(填“<”=”或“>”)。分析H3BO3的速率,va(逆)_______vb(正))(填“<”“=”或“>”)。
②根据化学反应原理,分析升高温度对制备B(OCH3)3反应的影响_______。
③若要进一步提高硼酸的转化率,除了可以适当改变反应温度外,还可以采取的措施有:_______。
(4)H3BO3溶液中存在如下反应:H3BO3(aq) +H2O(l)=[B(OH)4]-(aq)+H+(aq)。常温时,已知0.70molL-1H3BO3溶液中,平衡(H+)=2.0×10-5molL-1,水的电离可忽略不计,列式计算该反应的平衡常数K约为_______(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com