
分析 (1)根据w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出该溶液中溶质的质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算出该溶液的浓度;
(3)根据稀释过程中溶质的物质的量不变计算出稀释后溶液的浓度.
解答 解:(1)在76g水中溶解24g CuSO4,该溶液中溶质的质量分数为:$\frac{24g}{24g+76g}$×100%=76%,
答:该溶液中溶质的质量分数为24%;
(2)根据(1)可知,该溶液的质量分数为24%、密度为1g•cm-3,则该溶液的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1×24%}{160}$mol/L=1.5mol/L,
答:该溶液的物质的量浓度为1.5mol•L-1;
(3)取10mL该溶液加水稀释至200mL,稀释过程中溶质的物质的量不变,则稀释后的溶液物质的量浓度为:$\frac{1.5mol/L×0.01L}{0.2L}$=0.075mol/L,
答:稀释后溶液浓度为0.075mol•L-1.
点评 本题考查了物质的量浓度、溶质质量分数的计算,题目难度中等,明确物质的量浓度、溶质质量分数的概念及表达式为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| 化学反应 | 影响因素 | |
| A | H2O2不稳定,向溶液中加入少量MnO2后的分解速率明显加快 | 催化剂 |
| B | Na与O2反应既能生成Na2O也能生成Na2O2 | 温度 |
| C | 20mL双氧水比10mL双氧水产生更多的氧气 | 浓度 |
| D | 过氧化氢在酸、碱、中性条件下将高锰酸钾分别还原成Mn2+、MnO42-、MnO2 | 溶液的酸碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
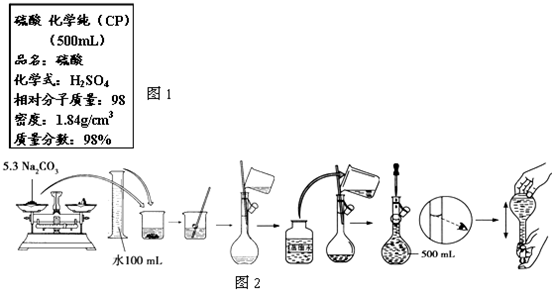
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家预言,燃料电池将是21世纪获得电能的重要途径.
科学家预言,燃料电池将是21世纪获得电能的重要途径.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com