
【题目】已知氨水的浓度越大,密度越小。将质量分数为W %的氨水和质量分数为5W %的氨水等体积混合,所得溶液中氨的质量分数为
A.6W %B.3W %C.大于3W %D.小于3W %
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关原子轨道的叙述中正确的
A.氢原子的2s轨道能量较3p轨道高
B.能层n=4的原子轨道最多可容纳16个电子
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多
D.锂原子的2s与5s 轨道皆为球形分布
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
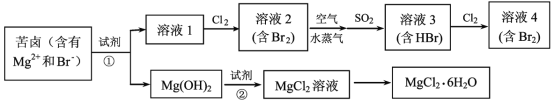
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:
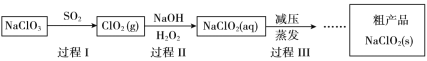
(1)NaClO2中氯元素的化合价是_________。从氧化还原角度推测NaClO2可能具有的化学性质是_________。
(2)过程I常伴有少量Cl2生成。
① Cl2的存在会造成产品中含有NaCl,请结合离子方程式解释其原因_________。
② 结合下面信息,请设计实验方案除去ClO2中的Cl2 ________。
ClO2 | Cl2 | |
在水中的溶解性 | 易溶 | 溶 |
在CCl4中的溶解性 | 难溶 | 溶 |
(3)过程II中H2O2的作用是________(填“氧化剂”或“还原剂”)。
(4)理论上每生成1 mol NaClO2,消耗SO2的体积是________L(标准状况下)。
(5)已知:
i. 压强越大,物质的沸点越高。
ii. NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O
38~60℃时析出NaClO2晶体
高于60℃时分解成NaClO3和NaCl
① 过程III采用“减压蒸发”操作的原因是_____。
② 请将过程III的操作补充完整_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,正确的是( )

A. 制备的乙酸乙酯中没有杂质
B. 该实验中浓硫酸的作用是催化剂和脱水剂
C. 石蕊层为三层环,由上而下是蓝、紫、红
D. 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com