
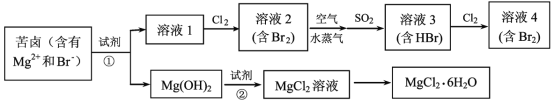
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
【答案】蒸馏或渗析或离子交换法(任写一种即可) < Br2 + SO2 + 2H2O ==2HBr + H2SO4 Ca(OH)2(或生石灰、NaOH) Mg(OH)2 + 2H+ == Mg2+ + 2H2O 蒸发浓缩,冷却结晶,过滤(减少溶剂浓缩,降温结晶,过滤)
【解析】
由题给流程可知,向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,过滤;向溶液1中通入氯气,氯气与溶液中的溴离子发生置换反应生成含有单质溴浓度较低的溶液2,用空气和水蒸气吹出溴蒸气,溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸的溶液3,再向所得溶液3通入氯气得到含溴浓度较高的溶液4;将氢氧化镁溶于盐酸中得到氯化镁溶液,氯化镁溶液蒸发浓缩,冷却结晶,过滤得到六水氯化镁。
(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法等,故答案为:蒸馏或渗析或离子交换法;
(2)由流程中提取溴的过程可知,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集,增大了溶液中溴的浓度,则溶液2中溴的浓度小于溶液4,故答案为:<;
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,溶液中溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸,反应的化学方程式为Br2 + SO2 + 2H2O =2HBr + H2SO4,故答案为:Br2 + SO2 + 2H2O =2HBr + H2SO4;
(4)向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,则试剂①可以选用Ca(OH)2(或生石灰、NaOH);将氢氧化镁溶于盐酸中得到氯化镁溶液,则试剂②为盐酸。反应的离子方程式为Mg(OH)2 + 2H+ =Mg2+ + 2H2O,故答案为:Ca(OH)2(或生石灰、NaOH);Mg(OH)2 + 2H+ = Mg2+ + 2H2O;
(5)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是蒸发浓缩,冷却结晶,过滤,洗涤得到,故答案为:蒸发浓缩,冷却结晶,过滤。


科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液。下列操作顺序正确的是
A. ①④②⑤③ B. ④①②⑤③ C. ④②⑤①③ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的部分流程如下:
![]()
下列说法不正确的是
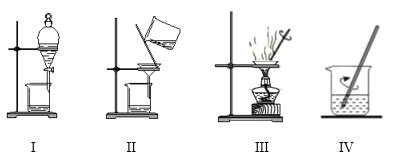
A. 完成步骤①需要装置IIIB. 完成步骤③需要装置II
C. 完成步骤⑤需要装置ID. 完成步骤②和④需要装置IV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H是一种光刻胶,其中的一种合成路线如下:

回答下列问题:
(1)B的化学名称是_________。
(2)B生成C的反应类型为_________,F与G反应生成H的反应类型为_________。
(3)H中官能团的名称为___________________________。
(4)C的结构简式为__________________,G的结构简式为__________________。
(5)已知E与D,F与CH3OH分别含有相同的官能团,写出D与CH3OH反应生成E和F的化学方程式:________。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,则X的结构简式有_____(不考虑立体异构)种,写出核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式:___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
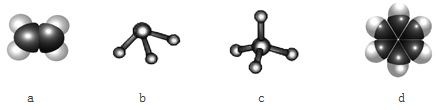
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
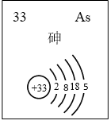
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
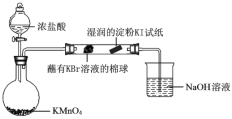
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨水的浓度越大,密度越小。将质量分数为W %的氨水和质量分数为5W %的氨水等体积混合,所得溶液中氨的质量分数为
A.6W %B.3W %C.大于3W %D.小于3W %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
①混合气体的密度②容器内气体的压强③混合气体的总物质的量④B物质的量浓度
A. ①④ B. ②③ C. ②③④ D. 只有④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com