
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)= ![]() mol·L-1
mol·L-1
C.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
D.混合溶液的pH=7
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C14H10O5 B. C14H16O4 C. C14H22O5 D. C14H18O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH在表示溶液的酸碱性方面有重要的应用,请按要求完成填空
(1)常温下,pH=12的NaOH溶液的其浓度c(NaOH)= mol/L.;
(2)常温下,某一元弱酸溶液的pH=1,其浓度 0.1 mol/L(填“>”、“<”或“=”);
(3)常温下,将100 mL 0.1 mol/L醋酸溶液和50 mL 0.2 mol/LNaOH溶液均匀混合后,溶液显 (填“酸性”、“碱性”或“中性”),其原因是 ;(请用相关的离子方程式作答)
(4)25℃时,若体积为Va、pH=a的某一元强酸HA与体积为Vb、pH=b的某一元强碱BOH混合恰好中和,且已知Va<Vb和a=0.5b,则 a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有强氧化性,可作为水处理剂和高容量电池材料。工业上生产高铁酸钾的工艺流程如下:

已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式____________。
(2)在“反应液Ⅰ”中加KOH固体的目的是____________________。
(3)生产K2FeO4的化学反应方程式为________________,制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是___________________。
(4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
① 向反应液Ⅱ中加入饱和________,在冰水浴中静置结晶后过滤,得K2FeO4粗产品;
② 将K2FeO4粗产品溶解在___________中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4;
③ 将K2FeO4晶体再用少量__________洗涤,低温真空干燥,得到高铁酸钾成品。
(5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【湖北省襄阳市第五中学2017届高三下学期第三次适应性考试】生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的装置中,A是实验室制备Cl2的发生装置,圆底烧瓶中盛放的是二氧化锰,C、D为气体净化装置;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶:烧杯G为尾气吸收装置。试回答:
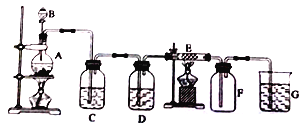
(1)C装置中试剂为______。
(2)E中的现象为______。
(3)写出在A、G中发生反应的离子方程式:A: ___________。G: ________________。
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2 KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①考试用“单线桥”标出电子转移的方向和数目: __________。
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20mL、12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到氯气在标准状况下的体积为_______。
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象说明SO2具有氧化性的是( )
A. SO2通入品红溶液中使之褪色。
B. SO2通入酸性 KMnO4溶液中使之褪色。
C. SO2通入溴水中使之褪色。
D. SO2通入饱和 H2S 溶液中析出浅黄色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017鹿城区校级模拟】下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是
A.SO2+2H2S═S+2H2O
B.2NaNO32NaNO2+O2↑
C.NH4NO3N2O↑+2H2O
D.3Cl2+6KOH═5KCl+KClO3+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com