
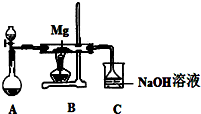
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与
| ||
| ||
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所的固体于试管I中 | |
| ② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 | 若试管I中 若试管I中的固体未完全溶解,且 |
| ||
| ||
| ② | 2mol/L 盐酸至过量; 品红 | 固体完全溶解; 品红溶液褪色; |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
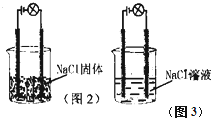 某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )
某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )| A、NaCl是电解质 |
| B、NaCl溶液是电解质 |
| C、NaCl在水溶液中电离出可以自由移动的离子 |
| D、NaCl溶液可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通道 |
| B、明矾可以用来净水 |
| C、胶态金属氧化物分散于玻璃中制成有色玻璃 |
| D、三氯化铁溶液中加入NaOH溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
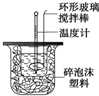 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com