


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
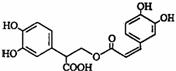 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图.下列叙述正确的是( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图.下列叙述正确的是( )| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和1mol氢气发生加成反应 |
| C、迷迭香酸可以发生水解反应但不能发生酯化反应 |
| D、迷迭香酸中只有一个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
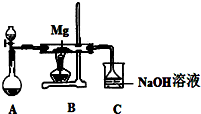 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与
| ||
| ||
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所的固体于试管I中 | |
| ② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 | 若试管I中 若试管I中的固体未完全溶解,且 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液放入试管中,滴加足量0.1mol/L BaCl2溶液,再加足量0.5mol/L HNO3 | 若出现白色沉淀,后白色沉淀完全溶解并放出气体 | 假设一成立 |
| ② | 假设二成立 | |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ |
| B、Fe3+ |
| C、K+ |
| D、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com