
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法正确的是( )
A. 从有机物分类看,它可属于“氨基酸类”“酯类”“芳香烃类”
B. 它能与盐酸反应,但不能与苛性钠溶液反应
C. 甲酸丁酯基(—COOC4H9)有3种不同结构
D. 它的分子式为C11H15NO2
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___。PO43-的空间构型是 ___,中心原子的杂化方式是 ____。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是 ___,原因是 ___。
(4)PH3是____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
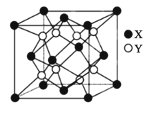
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
实验流程如下:
C6H12O6溶液![]()
![]()
![]() 滤液
滤液![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
已知:葡萄糖酸钙微溶于乙醇,可溶于冷水,易溶于热水。则下列说法不正确的是
A.第②步充分反应后CaCO3固体需有剩余,其目的是确保葡萄糖酸完全转化为钙盐
B.第④步加入乙醇的作用是减小葡萄糖酸钙在水中的溶解量,使其结晶析出
C.第⑤步过滤时,发现有固体产品残留在原容器壁上,可加少量热水冲洗再转移至过滤器内
D.可用O2代替Br2,在葡萄糖氧化酶作用下氧化葡萄糖进而制备葡萄糖酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚类化合物以其独特的化学结构使其拥有重要的生理活性,在农药、医药、化工、香料和染料等领域发挥着重要的作用。下图是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路线

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列问题
(1)B的结构简式为________,B分子中含有的官能团为________(填官能团名称)。
(2)反应③为取代反应,该反应的化学方程式为________。
(3)C的名称为________。
(4)A的结构简式为________,反应⑤的反应类型为________。
(5)B有多种同分异构体,其中与B含有相同官能团的同分异构体有________种。
(6)已知
参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4gNaOH固体溶于水,配成100mL溶液,其密度为1.22g/mL,请回答下列问题。
(1)从该溶液中取出10mL,其中NaOH的物质的量浓度为________,NaOH的质量分数为___________,溶液的密度为________,含NaOH的物质的量为_________;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_______。
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA,根据所学知识填空。
(1)3molH2O含有__个H2O;
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的质量是__g;
(3)已知NH3的相对分子质量为17,则NH3的摩尔质量为__g/mol;
(4)若某原子的摩尔质量为Mg·mol-1,则一个该原子的真实质量是___g;
(5)CO2中含有6.02×1023个O,则CO2的物质的量为__mol;
(6)6.02×1022个OH-的电子物质的量为___mol。
(7)已知一个铁原子的质量为bg,则铁的摩尔质量为___g/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com