
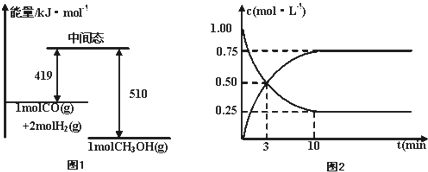
| 0.75 |
| 0.25×0.52 |
| 10-14 |
| 0.01mol/L |
| 10-14 |
| 10-a |
| 1 |
| 2 |
| 10-b |
| 2 |
| 10-b |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
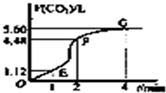 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
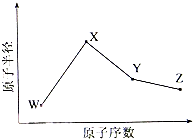 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:| 实验编号 | X | Y | Z |
| ① | 铁 | 石墨 | 足量饱和食盐水 |
| ② | 石墨 | 石墨 | 足量KOH溶液 |
| ③ | ? | ? | 足量?溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
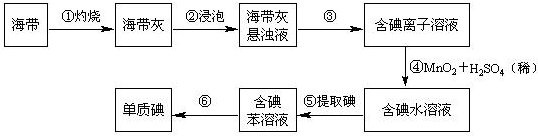
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com