
| A. | 是由一个1s轨道和一个2p轨道线性组合而成 | |
| B. | 等性sp杂化轨道中所含s、p的成分一样 | |
| C. | 等性sp杂化轨道有两个,一个能量升高,另一个能量降低,但总能量保持不变 | |
| D. | sp杂化轨道可与其他原子轨道形成σ键和π键 |
分析 A.sp杂化轨道,为同一原子内由一个ns轨道和一个np轨道发生的杂化;
B.原子轨道杂化后形成的杂化轨道是等同的,这种杂化叫做等性杂化,有孤对电子的存在的杂化为不等性杂化;
C.杂化轨道能量相等;
D.杂化轨道只形成σ键,不形成π键.
解答 解:A.1s轨道和一个2p轨道,不符合sp杂化轨道,需在同一原子内同一电子层内轨道发生的杂化,故A错误;
B.sp杂化是由s轨道和一个p轨道杂化形成两个能量均等的轨道,所以等性sp杂化轨道中所含s、p的成分一样,故B正确;
C.不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,为杂化,等性sp杂化,所形成两个能量等同的sp杂化轨道,故C错误;
D.杂化轨道用于成σ键或容纳孤对电子,剩余的轨道形成π键,不是杂化轨道形成π键,故D错误;
故选B.
点评 本题考查杂化轨道,掌握σ键和π键、sp杂化轨道相关知识是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,在氨水中加入少量NH4Cl固体.氨水的电离度和电离平衡常数均变小 | |
| B. | 滴加甲基橙显红色的溶液:NH4+、NO3-、I-、Cl-可以大量共存 | |
| C. | 若将等pH、等体积的NaOH溶液和氨水分别加水稀释m倍、n倍.稀释后两种溶液的pH仍相等,m<n | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合,所得溶液呈中性,则Va:Vb=10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中加入过量氯水:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 铁粉和FeCl3溶液反应:Fe+Fe3+=2Fe2+ | |
| C. | 铁粉和过量稀HNO3反应:Fe+NO3-+4H+=Fe3++NO↑+2H2O | |
| D. | Mg(HCO3)2溶液与过量NaOH溶液反应:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
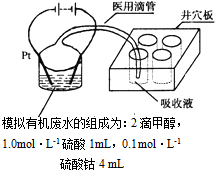 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+、Al3+、SO42-、NO3- | B. | Al3+、K+、Cl-、S2- | ||
| C. | NH4+、Cl-、K+、CO32- | D. | Ca2+、NO3-、HCO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )
常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )| A. | 常温下ka(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) | |
| B. | pH=13时,溶液中不存在HC03-的水解平衡 | |
| C. | pH由8~11时,$\frac{(C{O}_{3}^{2-})•c({H}^{+})}{c(HC{O}_{3}^{-})}$不变 | |
| D. | pH=3时,有c(NH4+)+c(NH3•H2O)═c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液中通入SO2后,颜色褪去,SO2表现了漂白性 | |
| B. | 铁粉投入同浓度的Cu(NO3)2和AgNO3混合液先析出Ag,说明Ag+氧化性比Cu2+强 | |
| C. | 常温下,将铝片放入浓硫酸中无明显现象,说明铝和冷的浓硫酸完全不反应 | |
| D. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、NaCl、NaAlO2 | B. | KNO3、NaCl、CH3COONa | ||
| C. | Na2S、(NH4)2SO3、AgNO3 | D. | Ba(NO3)2、FeSO4、NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | Fe5O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com