
����Ŀ����������10mL0.1mol/L��HR��Һ������0.1mol/L��NH3��H2O��Һ, ������ҺpH�������Ա仯��ͼ�����з�������ȷ����

A��a��b�㵼��������ǿ��˵��HRΪ����
B��b����ҺpH=7��˵��NH4Rû��ˮ��
C��c����Һ����c(NH4+)>c(R-)��c(OH-)>c(H+)
D��b��c�������Һ����c(H+)��c(OH-)=Kw=1.0��10-14
���𰸡�B
��������
��������������£���10 mL o��1 mol/L��HR��Һ����ε���0.l mol/L��NH3��H2O��Һ��A��a~b�㵼��������ǿ��������ӦΪHR+NH3��H2O=NH4R+ H2O����Һ����������ǿ��˵����Һ�е��Ũ������ԭ��Һ�е��Ũ���٣�����λ�������Һ�������ƶ��������٣���HRΪ������ʣ���A����ȷ��B��b�㵼��������ǿ����b��λ����ǡ����ȫ��Ӧ����Һ����ΪNH4R ��NH4+��R����Ӧ�ļ���Ϊ������ʣ������߶���ˮ�⣬pH =7��˵������ˮ��̶���ͬ����B�����C��c����ҺΪNH4R��NH3��H2O1:1�Ļ��Һ������ҺpH>7���ʴ���c(OH-)>c(H+)����ΪNH3��H2O�ĵ���̶ȴ���NH4+��ˮ��̶ȣ���c( NH4+)>c( R-)��C����ȷ��D����������ϵ�о�Ϊˮ��Һ��ϵ���ʳ����£�����������c(H+)��c(OH-)= Kw =l. 0��l0-14����D����ȷ������ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������Ԫ�����ڱ���һ����Ԫ�أ���Ԫ�ط����ش��������⣺
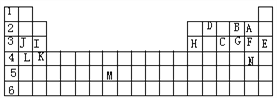
��1����������ĸ�����14��Ԫ���У���ѧ��������õ���________������Ԫ���н�������ǿ����____���ǽ�������ǿ�� __�������µ���ΪҺ̬�ķǽ���Ԫ����______��M���ڵ�����______��
��2��C��̬�⻯��Ļ�ѧʽ�ֱ�Ϊ____��A��B��C���⻯�������ȶ�����_______��
��3������������ԭ�Ӱ뾶��С����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ���������뻯ѧϢϢ��أ�����˵����ȷ���ǣ� ��
A. �ع�����Ҫ�ɷ���Һ̬�����ʵع��;������������Ϊ����ȼ�͡�
B. �����г��õľ�����������˽����Ӿ�����ʡ�
C. ��������п�����������������������������ʴ��
D. ���ά�ijɷ��Ǿ���衣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ºϳɵ�һ��������̼�Ǽܳ��������壨��ͼ��ʾ��̼̼��������ȣ���

��1��д�������ķ���ʽ__________��
��2��������һ�ȴ����Ƿ���ͬ���칹��_______________ ��
��3�����������ȴ����ж�����ͬ���칹��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ���)��

ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
��1��A�в�������ɫ���壬�����ʽ��________��
��2����֤������������ǿ�ڵ��ʵ��������_________________________________________��
��3��B����Һ������Ӧ�����ӷ���ʽ��_____________________________________________��
��4��Ϊ��֤���������ǿ�ڵ⣬�������IJ�����������__________________________________________________________________________________________________________��
��5��������ʵ���Ŀ����________________________________________________________��
��6���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ���__________________���õ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��ֵ�һ����Ȼ��ʮ������������Al��Cu.Fe���ֽ���Ԫ����ɣ��ش��������⣺
��1����ͭԪ��λ�����ڱ���_____����Cu2+���ӵļ۲�����ʾʽΪ____��
���̡�����������Ԫ�ص����������±���
������/KJ/mol | I1 | I2 | I 3 | I4 |
Mn | 717.3 | 1509.0 | 3248 | 4940 |
Fe | 762.5 | 1561.9 | 2957 | 5290 |
Co | 760.4 | 1648 | 3232 | 4950 |
��Ԫ�صĵ������������Ե�����Ԫ�غ���Ԫ�أ���ԭ����____��
��ʵ���ҿ��ó�Ѫ��K3[Fe(CN)6]����Fe2+���ӣ��ڳ�Ѫ������Ԫ�صĻ��ϼ�Ϊ____���������ӵ���λ��Ϊ______��
��2�����÷�Ӧ��X+C2H2+NH3��Cu2C2+NH4Cl(δ��ƽ)�ɼ�����Ȳ��
�ٻ�����X�����ṹ��ͼ���ݴ˿�֪X�Ļ�ѧʽΪ_______��

����Ȳ�����ЦҼ���м���Ŀ֮��Ϊ______��̼ԭ�ӵ��ӻ���ʽΪ_______��NH4+�ռ乹��Ϊ______����������������
��3�����������ֻ�����a��AlCl3 b��NaCl c��Al2O3�е��ɸߵ���������_______�����ţ�����ԭ����____________��
��Al������ԭ�Ӳ�ȡ�����������ܶѻ����侧���߳�Ϊ0.405nm����ʽ��ʾAl���ʵ��ܶ�_______g/cm3�����ؼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij��ȤС��������ͼװ�òⶨij���Ṥ���ŷ�β���ж�������ĺ�����ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ�������֪Ũ�ȵĵ�ˮ�вⶨSO2�ĺ�������ϴ��ƿC����Һ��ɫ��ʧʱ�������رջ���A��

��1�� C�е���ĩ������һ���������D���������ʵ���ȷ�ȣ���������_________________��
��2��C�з�����Ӧ�����ӷ���ʽ ��
��3��C����Һ��ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2���� (�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
����ʵ���ҳ���Na2SO3������Ũ���ᷴӦ��ȡSO2 ��
��4���������Ƶ�SO2�ı�����Һ�������ô���Һ�������Լ���ѡ�������һ����ʵ�飬�Ƚ�SO2��Fe2+ ��ԭ�Ե�ǿ����Ҫ��д��ʵ�鲽�衢����ͽ��ۣ� ��
��5��ij�о�С��ⶨ���ֱ��ʵ�Na2SO3������Ʒ��Na2SO3�ĺ�����
�� ȡa��Na2SO3������Ʒ���Ƴ�100mL��Һ��ȡ10.00mL����Һ����ƿ�У����뼸�ε�����Һ��ָʾ����0.0100mol/L��ˮ���еζ����ζ��յ�����Ϊ ����¼���ݣ��ظ��ζ�2�Σ�ƽ�����ĵ�ˮ20.00mL��
�� ���㣺��Ʒ���������Ƶ���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g)��I2(g)![]() 2HI(g)����H����a kJ��mol��1
2HI(g)����H����a kJ��mol��1
��֪��![]()
![]() ������˵������ȷ����(����)
������˵������ȷ����(����)
A. ��Ӧ��������������������������
B. �Ͽ�2 mol H��I����������ԼΪ(c��b��a)kJ
C. �Ͽ�1 mol H��H����1 mol I��I�������������ڶϿ�2 mol H��I����������
D. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�T1��T2ʱ���ֱ�0.50 mol CH4��1.20 mol NO2�������Ϊ1L���ܱ������У��������·�Ӧ��CH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g�������n��CH4����ʱ��仯�������±���
ʱ��/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n��CH4��/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4��/mol | 0.50 | 0.30 | 0.18 | �� | 0.15 |
����˵����ȷ���ǣ�������
A. T2ʱ��NO2��ƽ��ת����Ϊ70.0%
B. �÷�Ӧ����H��0��T1��T2
C. ���������������䣬T1ʱ��ƽ����ϵ���ٳ���0.30molCH4��0.80molH2O��g����ƽ��������Ӧ�����ƶ�
D. ���������������䣬T1ʱ��ƽ����ϵ���ٳ���0.50molCH4��1.20molNO2����ԭƽ����ȣ�����ƽ��ʱN2��Ũ���������������С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com