
【题目】下表标出的是元素周期表的一部分元素,用元素符号回答下列问题:
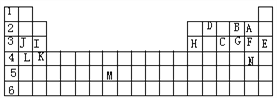
(1)表中用字母标出的14种元素中,化学性质最不活泼的是________,主族元素中金属性最强的是____,非金属性最强是 __,常温下单质为液态的非金属元素是______;M所在的族是______。
(2)C气态氢化物的化学式分别为____,A、B、C的氢化物中最稳定的是_______。
(3)第三周期中原子半径最小的是________________。
【答案】 Ar K F Br ⅦB PH3 HF Cl
【解析】表中14种元素按字母顺序分别是F、O、P、C、Ar、Cl、S、Al、Mg、Na、Ca、K、Tc、Br。
(1). 表中用字母标出的14种元素中,化学性质最不活泼的是稀有气体Ar,主族元素中金属性最强的是碱金属元素K,非金属性最强是F,常温下单质为液态的非金属元素只有一种,就是Br;元素周期表有18列分成16个族,从左到右依次是IA、IIA、IIIB、IVB、VB、VIB、VIIB等等,M位于第7列,所以它所在的族是ⅦB。
(2). C气态氢化物的化学式分别为PH3,F、O、P的氢化物中最稳定的是HF。
(3). 同一周期元素从左到右原子半径依次减小,所以第三周期中原子半径最小的是Cl(稀有气体的原子半径测定方法与主族元素不同,所以不参与比较。)。


科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10 mol L–1氨水中滴入0.10 mol L–1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol L–1氨水的电离度为1.32%,下列有关叙述正确的是

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2浓度的持续走高引起人们的髙度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉” CO2的方法。
方法I :一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示。

(1)太阳能加热的反应器是将_______能转化为________能。
(2)步骤二中发生反应的化学方程式是____________________ 。
方法II :另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示。

(3)NaOH溶液喷成雾状是为了_________,其中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1) 配制待测液:称取6.0 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液。
(2) 滴定:
①用_______量取15.00 ml.待测液。
②向锥形瓶中加入几滴甲基橙,用0.2010 mol L-1的标准硫酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,滴定终点时的现象为________________。
(3)数据处理
实验次 序编号 | 硫酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
1 | 19.90 | 15.00 |
2 | 20.10 | 15.00 |
3 | 22.00 | 15.00 |
4 | 20.00 | 15.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为______________,碱的纯度为_______________(保留两位小数)。
(4)—定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
__________________(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要验漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏小
E.配制标准溶液时,定容时俯视读数,则导致滴定时测得的NaOH溶液的浓度偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏小
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
I.在滴定过程中,不慎将数滴酸液滴在锥形瓶外,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A.5.25 mol·L-l B.12.5 mol·L-l C.7.5 mol·L-l D.6.25 mol·L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com