
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.分析 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,则C原子核外电子排布式为1s22s22p4,故C为O元素,由原子序数可知B为N元素;E、F和C位于同一主族,F处于第一个长周期,则E为S元素,F为Se;D为它所在周期中原子半径最大的主族元素,处于ⅠA族,原子序数大于O元素且小于硫,故D为Na.
解答 解:原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,则C原子核外电子排布式为1s22s22p4,故C为O元素,由原子序数可知B为N元素;E、F和C位于同一主族,F处于第一个长周期,则E为S元素,F为Se;D为它所在周期中原子半径最大的主族元素,处于ⅠA族,原子序数大于O元素且小于硫,故D为Na.
(1)F 为Se,处于第四周期VIA族,原子基态的外围核外电子排布式为4s24p4,
故答案为:4s24p4;
(2)由C、N、O形成的离子OCN-与CO2互为等电子体,则OCN-的结构式为:[N=C=O]-,
故答案为:[N=C=O]-;
(3)元素碳与硫所形成的常见化合物为CS2,与CO2的结构类似,均为直线形结构,碳原子轨道的杂化类型为sp,
故答案为:sp;
(4)由晶胞结构可知,晶胞中存在[NO2]结构微粒,微粒数目为1+8×$\frac{1}{8}$=2,晶胞中钠原子数目为8×$\frac{1}{4}$=2,
故该晶体化学式为NaNO2,
故答案为:NaNO2;
(5)①A.N2O与CO2是等电子体,二者结构相似,则N2O为直线型分子,故A正确;
B.同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,由于氮原子2p轨道是半满稳定结构,第一电离能高于同周期相邻元素的,所以其第一电离能大小顺序是:N>O>C,故B错误;
C.CH2=CH-CHO分子中每个碳原子均形成三个σ键,没有孤对电子,均采用sp2杂化,故C正确;
D.HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,HCOOH沸点比CH3OCH3高,故D错误.
故选:AC;
②Fe2+含有空轨道,为中心离子,NO、H2O含有孤对电子,为配体,
故答案为:NO、H2O;Fe2+.
点评 本题考查物质结构与性质,推断元素是解题关键,涉及核外电子排布、等电子体、电离能、杂化方式与空间构型判断、氢键、配合物、晶胞计算等,难度中等,注意理解同周期第一电离能异常情况,注意氢键对物质性质的影响.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
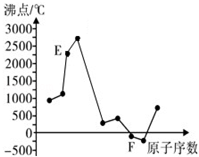 A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).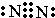 ,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).
,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
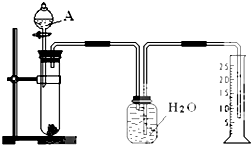 某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:
某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
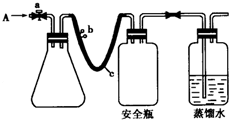 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
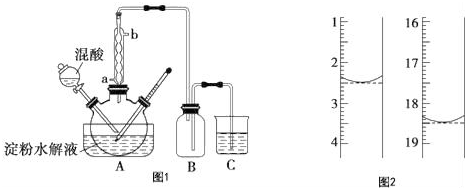
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
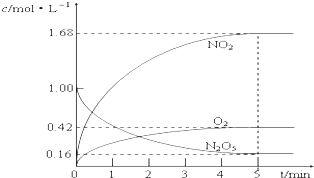 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com