
【题目】滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为____,为何此种情况能测出NaOH的含量?____。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?____,请说明理由:___。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-=2I-+S4O62-)。取用Na2S2O3的标准溶液应该用_____式滴定管。有关实验数值如表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
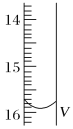
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | V=_____ |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为_____,下列操作中,会导致所测得的碘元素的百分含量偏大的是____。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
【答案】由红色变成无色 滴定终点时溶液呈弱碱性,BaCO3不参与反应 不能 因为活塞处无刻度,无法准确地读出所用标准盐酸的体积 碱 15.90 0.03175% b
【解析】
(1)①根据酚酞的变色范围是8~10分析;
②根据滴定管的下端无刻度判断;
(2)碱性溶液用碱式滴定管盛放;依据滴定管的科学读数方法读取数据;先求出三次的体积,根据数据的有效性,舍去第1组数据,然后求出2、3组平均消耗V(Na2S2O3),由浓度求出其物质的量,再根据方程式中的关系求出25mL待测溶液中KIO3的物质的量,然后求出KIO3的总物质的量和质量,其质量分数=![]() ×100%;根据错误操作对消耗的标准溶液体积的影响分析误差。
×100%;根据错误操作对消耗的标准溶液体积的影响分析误差。
(1)①当达到终点时,溶液显弱碱性,酚酞由红色变为无色;酚酞的变色范围是810,此时BaCO3不溶解,标准液的体积不变,不影响NaOH含量的测定;
故答案为:由红色变成无色;滴定终点时溶液呈弱碱性,BaCO3不参与反应;
②根据滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积,则不能测出NaOH含量;
故答案为:不能,因为活塞处无刻度,无法准确地读出所用标准盐酸的体积;
(2)碱性溶液用碱式滴定管盛放,Na2S2O3在溶液中水解显碱性,所以用碱式滴定管盛放;由图可知,滴定管读数为15.90;三次消耗的Na2S2O3的体积分别为15.90mL,14.99mL,15.01mL,第一次数据误差过大,应该舍去;另外两次的平均值为![]() =15.00mL,则n(Na2S2O3)=cV=5.0×104molL1×0.015L=7.5×106 mol,已知发生反应为:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32=2I+S4O62,则
=15.00mL,则n(Na2S2O3)=cV=5.0×104molL1×0.015L=7.5×106 mol,已知发生反应为:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32=2I+S4O62,则
KIO33I26S2O32
1 6
n 7.5×106mol
所以n(KIO3)=![]() mol=1.25×106 mol,则KIO3的总物质的量为:1.25×106mol×
mol=1.25×106 mol,则KIO3的总物质的量为:1.25×106mol×![]() =1.25×105 mol,则n(I)=n(KIO3)=1.25×105 mol,m(I)=nM=1.25×105 mol×127g/mol=1.5875×103 g,所以碘盐中碘元素的百分含量为
=1.25×105 mol,则n(I)=n(KIO3)=1.25×105 mol,m(I)=nM=1.25×105 mol×127g/mol=1.5875×103 g,所以碘盐中碘元素的百分含量为![]() ×100%=0.03175%;
×100%=0.03175%;
a.滴定终点时,俯视刻度,则读数偏小,所以标准溶液的体积偏小,求出KIO3的物质的量的偏小,所以所测得的碘元素的百分含量偏小,a项错误;
b.没有用Na2S2O3标准溶液润洗相应的滴定管,则Na2S2O3的浓度减小,滴定时消耗的Na2S2O3的体积偏大,求出KIO3的物质的量的偏大,所以所测得的碘元素的百分含量偏大,b项正确;
c.锥形瓶中有少量的蒸馏水对测定结果无影响,c项错误;故选b,
故答案为:碱;15.90;0.03175%;b。


科目:高中化学 来源: 题型:
【题目】实验室需配制80mL0.1mol/L的碳酸钠溶液,填空并回答下列问题:
(1)配制80mL1.0mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
___ | ___ |
(2)配制时,其正确的操作顺序为___(用字母表示,每个字母只能用一次)。
A.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
B.将容量瓶盖紧,上下颠倒,摇匀
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
F.改为胶头滴管加水,使溶液凹液面恰好与刻度线相切
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若定容时仰视刻度线,结果会___;
若容量瓶中有少量蒸馏水,结果会___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
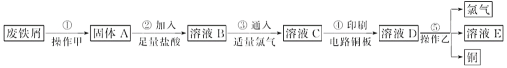
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________(填序号)。
A 先加氯水,后加KSCN溶液后显红色
B 先加KSCN溶液,不显红色,再加氯水后显红色
C ④只滴加KSCN溶液不显红色
(2)步骤③的离子方程式为__________。步骤④的化学方程式为___________。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室某硫酸试剂瓶标签上的部分内容,据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2mol/L
B.该硫酸与等体积的水混合所得溶液的质量分数等于49%
C.配制500mL4.6mol/L的稀硫酸需取该硫酸125.0mL
D.1molFe与足量的稀硫酸反应,标准状况下产生44.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生。(2)第二份加足量NaOH溶液加热后,收集到0.04mol气体。(3)第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。综合上述实验,你认为以下结论正确的是( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-、Cl-
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+
D.该混合液中:c(K+)≥0.2mol/L,c(CO32-)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是____(填元素编号)。d、e、f三种元素的原子结构上的相同点是___。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是____;六种元素中,最高价氧化物对应水化物的酸性最强的是____(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_____(选填“强”、“弱’’)。
(4)若b为非金属元素,则以下推断正确的是____(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL0.1mo/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再充分灼烧后得到固体的质量为( )
A.1.44gB.1.6gC.1.8gD.2.14g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com