
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
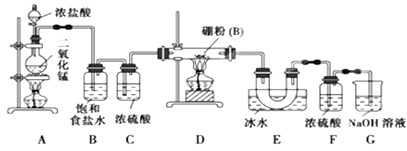
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2B+3Cl2
Mn2++Cl2↑+2H2O 2B+3Cl2![]() 2BCl3 除去Cl2中的HCl 冷却和收集三氯化硼 碱石灰 a 先用Cl2排尽装置中的空气,避免氧气和硼粉反应生成B2O3
2BCl3 除去Cl2中的HCl 冷却和收集三氯化硼 碱石灰 a 先用Cl2排尽装置中的空气,避免氧气和硼粉反应生成B2O3
【解析】
A装置制备氯气,制备的氯气中含有HCl、水蒸气,B装置吸收HCl,C装置干燥氯气,D装置中氯气与硼反应生成BCl3,E装置冷却和收集三氯化硼,三氯化硼遇水水解,F装置防止水蒸气进入E中,氯气有毒,直接排放会污染空气,G装置吸收氯气,据此判断。
(1)装置A用来制备氯气,其中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置D中氯气与硼在加热条件下反应生成三氯化硼,反应的化学方程式为:2B+3Cl2![]() 2BCl3;
2BCl3;
(3)浓盐酸易挥发,制备的氯气中含有HCl,B中饱和食盐水除去Cl2中的HCl,且可以降低氯气溶解度,BCl3的沸点低,E中冰水冷却便于收集三氯化硼;
(4)由于三氯化硼遇水水解,F装置防止水蒸气进入装置E中,同时氯气有毒需要尾气处理,则可以用一个盛装碱石灰的干燥管代替装置F和G;
(5)先用Cl2排尽装置中的空气,避免氧气和硼粉反应生成B2O3,再加热制备三氯化硼,故先点燃A处酒精灯,后点燃D处酒精灯,答案选a。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作或说法中不正确的是( )
A.过滤后滤液仍然浑浊,无需再过滤了
B.实验室制备蒸馏水的实验中,弃去开始盛接在锥形瓶中的液体
C.萃取分液操作用到分液漏斗
D.蒸发食盐水所用的蒸发皿不需要垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底辅薪,发火煅红,……冷淀,毁罐取出,……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是
A. 倭铅就是金属锌
B. 该冶炼锌的方法属于热还原法,煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D. 能用类似于此方法冶炼的金属有:Mg、Fe、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在农药、制药行业中用途广泛,沸点为77℃,遇水剧烈反应,液面上产生白雾,并产生带有刺激性气味的气体。实验室用干燥的Cl2与SO2合成SOCl2,反应原理是:SO2+Cl2+SCl2==2SOCl2。回答以下问题:
(1)氯气的制备
氯气的制备可选择下列装置完成:

①制取氯气的发生装置可以选择上图中的______,反应的化学方程式________________________。
②预收集一瓶干燥纯净的氯气,选择上图中的装置,其连接顺序为:_____________。(按气流方向,用小写字母表示)。
(2)二氧化硫的制备
按下图提供的装置、试剂,制取SO2反应的化学方程式为___________________________。

(3)氯化亚砜的制备
在仪器I中Cl2与SO2反应成合SOCl2
①仪器J的名称是________,冷凝水入口是_____,装置K的作用是____________________________________________________________。
②本实验的主要副产物是SCl2,已知:SOCl2沸点为77℃,SCl2的沸点为50℃,提纯SOCl2的实验操作是____________;
(4)氯化亚砜的性质与检测
某同学认为,SOCl2与水反应后的溶液中有盐酸和亚硫酸生成。
欲证明反应后形成的溶液中有H2SO3,可以使用的试剂是_________________。
欲证明反应后形成的溶液中有Cl-,实验的操作方法是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐D.Fe2O3和Al2O3都属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞化合物的叙述,不正确的是
A. 蛋白质肽链的盘曲和折叠被解开时,其特定功能会发生改变
B. RNA与DNA的分子结构相似,由四种核苷酸组成,可以储存遗传信息
C. 胆固醇、性激素、维生素D都属于固醇
D. 淀粉和糖原是各种生物体的储存能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列方程式的书写及配平。
(1) _____NaBO2+____SiO2+____Na+____H2=____NaBH4+____Na2SiO3;________
(2) _____P+____FeO+_____CaO ![]() _____Ca3(PO4)2+____Fe;________
_____Ca3(PO4)2+____Fe;________
(3) _____P4+_____KOH+_____H2O=_____K3PO4+_____PH3;________
(4) _____BiO3-+_____Mn2++_______=_____Bi3++_____ MnO4-+________;_______。
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________________。
(6)烟气中含有SO2和NO,写出用NaClO2溶液将烟气中NO转化成NO3-的离子方程式:________________。
(7)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4- (B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com