
【题目】完成下列方程式的书写及配平。
(1) _____NaBO2+____SiO2+____Na+____H2=____NaBH4+____Na2SiO3;________
(2) _____P+____FeO+_____CaO ![]() _____Ca3(PO4)2+____Fe;________
_____Ca3(PO4)2+____Fe;________
(3) _____P4+_____KOH+_____H2O=_____K3PO4+_____PH3;________
(4) _____BiO3-+_____Mn2++_______=_____Bi3++_____ MnO4-+________;_______。
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________________。
(6)烟气中含有SO2和NO,写出用NaClO2溶液将烟气中NO转化成NO3-的离子方程式:________________。
(7)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4- (B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为______________。
【答案】1 2 4 2 1 2 2 5 3 1 52 9 3 3 55 2 14H+ 5 2 7H2O2Fe2++H2O2+2H+=2Fe3++2H2O4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-
【解析】
(1)该反应中NaBH4中H:0→-1价,降1价,生成1个NaBH4降4价;钠单质中Na元素化合价由0→+1价,升1价,根据化合价升降相等,NaBH4前配1,Na前配4,根据H元素守恒H2前配2,根据B元素守恒原子守恒NaBO2前配1,根据钠元素守恒Na2SiO3前配2,根据Si元素守恒SiO2前配2,配平方程式为:NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,故答案为:1 2 4 2 1 2;
(2)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,故答案为:2 5 3 1 5;
(3)只有P元素的化合价变化,由0升高为+5价,由0降低为-3价,由电子、原子、电荷守恒可知反应为2P4+9KOH+3H2O═3K3PO4+5PH3,故答案为:2 9 3 3 5;
(4)发生BiO3-→Bi3+的反应,Bi元素由+5价降低为+3价即发生还原反应,一个氧化还原反应体系则还要发生氧化反应即Mn2+→MnO4-,Mn元素由+2升高为+7,发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,由电子守恒及质量守恒定律可知,该反应为5BiO3-+2Mn2++14H+═5Bi3++2MnO4-+7H2O,故答案为:5 2 14H+ 5 2 7H2O;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,发生的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)废气中的NO与NaClO2反应,NaClO2具有氧化性,NO具有还原性,发生氧化还原反应,生成NO3-、SO42-,则此反应的离子方程式为4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O,故答案为:4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O;
(7)向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-,故答案为:2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×1017 ,Ksp (AgSCN,白色 )= 1.0×1012 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
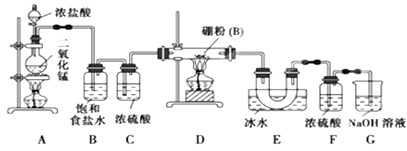
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2-丁烯有顺、反两种异构体,在其条件下可种气体处于平衡,

 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A. 顺-2-丁烯比反-2-丁烯稳定
B. 加压和降温有利于平衡向生成顺-2- 丁烯反应方向移动
C. .顺-2-丁烯的燃烧热比反-2-丁烯小
D. 反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯丁橡胶M是理想的电线电缆材料。工业上可由有机化工原料A 或E制得,其合成路线如下图所示。
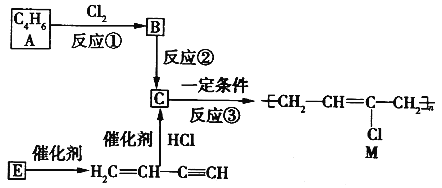
已知:①R-CH2-CH2Cl---R-CH=CH2+NaCl+H2O
②H2C=CH-C≡CH由E二聚得到。
完成下列填空:
(1)A的名称是________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式_______________。
(3)为研究物质的芳香性。将E三聚、四聚成环状化合物: 写出它们的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属钠投入饱和MgCl2溶液中,下列现象合理的是
A.开始时,钠浮在液面上、四处游动并熔成小球
B.反应结束后,在溶液底部有银白色金属产生
C.反应结束后,在溶液中无沉淀生成
D.反应结束后,在溶液底部析出黑色固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com