
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
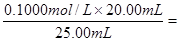 0.0800 mol·L-1。
0.0800 mol·L-1。

科目:高中化学 来源:不详 题型:单选题
| A.CO(g) +2H2(g)=CH3OH(g) |
| B.CaCO3(s)+2HCI(g)=CaCl2(s)+CO2(g)+H2O(l) |
| C.2H2(g)+O2(g)=2H2O(l) |
| D.2HgO(s)=2Hg(l)+O2(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 3 |
| 2 |
| A.-2491kJ?mol-1 | B.+859kJ?mol-1 |
| C.-1403kJ?mol-1 | D.-859kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| 1 |
| 2 |
| A.吸热88kJ | B.吸热44kJ |
| C.放热44kJ | D.吸热2.44kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 |
| B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
| C.燃烧热或中和热是反应热的种类之一 |
| D.吸热反应没有利用价值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度  I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=4的醋酸中:c(H+)=4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该硝酸中水电离出的c(H+)=1.0×10-3mol/L |
| B.加水稀释到原溶液体积的100倍,硝酸溶液的pH为5 |
| C.相同温度下,pH=3的CH3COOH溶液的物质的量浓度与该硝酸相同 |
| D.该硝酸中加入少量的Zn粒产生H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com