
【题目】氢、碳和氯的单质及化合物在生产和生活中有广泛用途。
(1)H2(g)+Cl2 (g) =2HCl(g) ΔH反应的能量变化示意图如图1所示,其中436kJ/mol表示的含义是_____,由图计算ΔH=____kJ/mol。
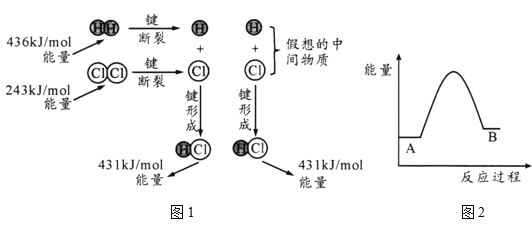
(2)金刚石、石墨的燃烧热分别为395.4kJ/mol和393.5kJ/mol。图2是两者相互转化的能量变化示意图,A表示的物质为_____。
【答案】1molH2分子中的化学键断裂时需要吸收的最少能量(或H-H键的键能) -183 石墨
【解析】
(1)根据图示,436kJ/mol是H-H键的键能;结合ΔH=反应物的键能之和-生成物的键能之和计算;
(2)根据金刚石、石墨的燃烧热判断金刚石和石墨能量的相对大小再结合图像分析判断。
(1)根据图示,436kJ/mol表示1molH2分子中的化学键断裂时需要吸收的能量(或H-H键的键能);ΔH=反应物的键能之和-生成物的键能之和,则H2(g)+Cl2 (g) =2HCl(g) ΔH=(436kJ/mol+243kJ/mol)-2×431kJ/mol=-183 kJ/mol,故答案为:1molH2分子中的化学键断裂时需要吸收的最少能量(或H-H键的键能);-183;
(2)金刚石、石墨的燃烧热分别为395.4kJ/mol和393.5kJ/mol,说明金刚石的能量较高,因此能量较低的A表示石墨,故答案为:石墨。


科目:高中化学 来源: 题型:
【题目】如图是常见的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一(反应中生成的部分物质已略去)。
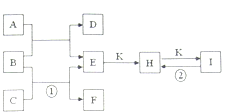
(1)K的分子式为___。
(2)物质A的常见用途为________(任写一种即可)。
(3)反应①的化学方程式为______。
反应②的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)____________________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)_________,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体有______性;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)能否用澄清石灰水鉴别(2)中产生的两种气体 (填“能”或“不能”)________,若不能,请写出两种可以鉴别这两种气体的试剂:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
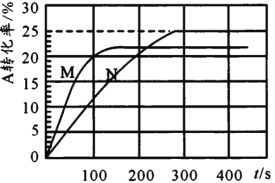
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
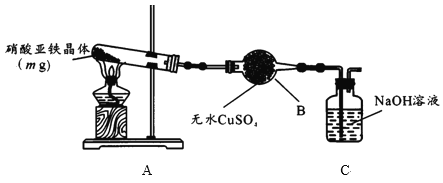
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB是一种树脂,有机物K是一种抗惊厥药物,它们的合成路线如下:
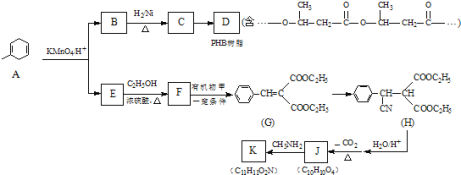
已知:R、R′、R″代表烃基
①RCN→H2O/H+RCOOH
②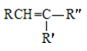
![]() RCOOH+
RCOOH+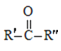
③
![]()
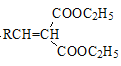 +H2O
+H2O
(1)B→C的反应类型是_____.
(2)写出一定条件下C→D的化学方程式_____:.
(3)有机物甲的结构简式为_____.
(4)写出E→F的化学方程式_____.
(5)已知1mol J最多与2mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环.写出一定条件下J→K的化学方程式:_____.
(6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为(写出一种即可)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业是制取高铁酸钾(K2FeO4),是先制取高铁酸钠,然后在低温下,往高铁酸钠溶液中加入KOH至饱和就可以析出高铁酸钾。湿法制备Na2FeO4的主要反应为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;干法备Na2FeO4的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+O2↑。下列有关说法不正确的是( )
A.湿法和干法制备中,生成1molNa2FeO4转移电子数目相同
B.高铁酸钾在低温下的溶解度比高铁酸钠的溶解度小
C.干法制备的主要反应中Na2O2是氧化剂
D.K2FeO4处理水时,既能杀菌消毒,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com