
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如方程式①②所示:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=+49.0kJmol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
③H2(g)+![]() O2(g)=H2O(g);△H=-241.8kJmol-1
O2(g)=H2O(g);△H=-241.8kJmol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJmol-1
B.反应①中的能量变化如图所示
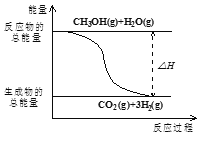
C.CH3OH转变成H2的过程一定要吸收能量
D.根据以上反应可知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
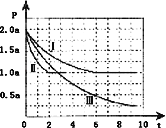
(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A. 图甲 中的ΔH1>ΔH2
中的ΔH1>ΔH2
B. 图乙 表示可逆反应A(s)+3B(g)2C(g) ΔH>0
表示可逆反应A(s)+3B(g)2C(g) ΔH>0
C. 图丙 表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D. 由图丁 可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温下,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
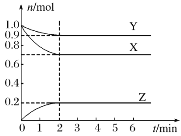
(1)反应开始至2min,以气体Z表示的平均反应速率为___;
(2)达平衡时X与Y的转化率之比为__;
(3)反应达到平衡时:压强是开始时的__倍;
(4)若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
(5)达平衡时该反应放出9.2kJ的热量,则该反应的热化学方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com