
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
【答案】D
【解析】A.该反应前后气体的物质的量不等,容器①、②中气体的压强不等,平衡状态不同,反应物X2的转化率不同,故A错误;B.该反应前后气体的物质的量不等,容器①、②中气体的压强不等,平衡状态不同,达平衡时,两个容器中XY3的物质的量浓度不等,故B错误;C. 该反应前后气体的物质的量不等,容器①、②中气体的压强不等,反应速率不等,容器①、②达到平衡时间不同,故C错误;D.①容器中放出23.15kJ热量,则生成XY3的物质的量为: ![]() =0.5mol,容器②恒温恒压,反应过程中压强比容器①大,生成XY3的物质的量>0.5mol,放出的热量多,即Q大于23.15 kJ,故D正确;故选D。
=0.5mol,容器②恒温恒压,反应过程中压强比容器①大,生成XY3的物质的量>0.5mol,放出的热量多,即Q大于23.15 kJ,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】己知有机物A是一种重要的化工原料,转化关系如下图:
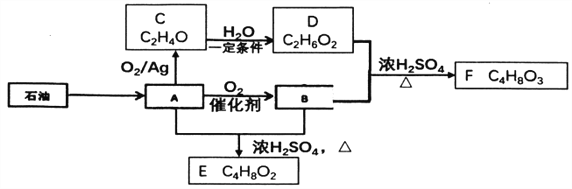
已知:同一碳原子上连接2个或2个以上-OH是不稳定结构,E能发生水解反应
请回答:
(1)A中官能团名称________。
(2)有机物C的结构简式________。
(3)B+D-F的化学方程式是________。
(4)已知![]() 能按下图方式进行裂解:
能按下图方式进行裂解:
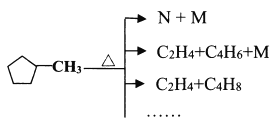
下列说法不正确的是________。
A.可用溴水区分![]() 和N
和N
B.E和![]() 都可以使酸性KMnO4褪色
都可以使酸性KMnO4褪色
C.等质量的A和![]() 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
D.N(五元环)可能的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途。回答下列问题:
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液: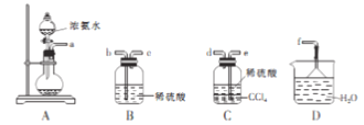
(1)用装置A制备氨气时,检验a处是否有氨气产生的方法是____________________。
(2)制取(NH4)2SO4 溶液时仪器连接的顺序(用接口字母和箭号“→”表示)是a→______________(所选装置不重复使用)。
(3)将装置C中两种液体分离,所需的主要玻璃仪器是______________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用用氢氧化镁热分解氯化铵制干燥氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
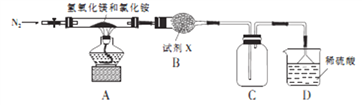
(4)氯化铵的电子式为_________________,装置A中发生反应生成碱式氯化镁的化学方程式为_____________________。
(5)装置B中试剂X为_______________________。
(6)上述装置图中有一处错误,请指出改正的方法:_______________________。
(7)MgCl2·6H2O在空气中加热,生成Mg(OH)Cl,若由MgCl2·6H2O制备无水MgCl2,实验方法为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )

A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅲ是升高温度的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:

(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在![]() ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢气是一种清洁能源,其来源可以是:
途径1.用太阳能分解水生成氢气 途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
已知:在25℃、101kPa时 2CO(g)+ O2 (g) ===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。补全该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH =_________
(2)已知拆开与形成1mol化学键需要相同的能量,途径2中,拆开1mol H-H键需能量是ckJ、1molH-O键是bkJ、1mol C-H键是akJ,则拆开1mol CO(g)化学键需要能量是_______kJ (用含字母的式子表示)
(3)CH4燃烧生成CO2和气态H2O的热化学方程式为__________
II.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。
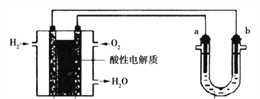
(4)燃料电池工作时,正极反应为:______________。
(5)U型管中装CuSO4溶液时,a、b两极均是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积比是:________。
(6)U型管中装饱和NaCl水溶液时,电解总反应的离子方程式是______________。
(7)用惰性电极电解M(NO3)x的水溶液,当阴极上增重m克时,在阳极上同时产生nL氧气(标准状况),从而可知M的相对原子质量是_________。(用含字母的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。
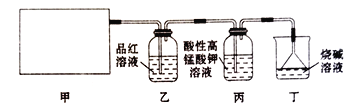
回答下列问题:
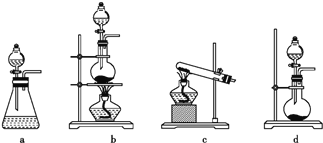
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。
(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性,证明SO2具有漂白性的现象为___________________________________。
(3)丁装置的作用是____________,写出其中发生主要反应的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com