
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )

A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅲ是升高温度的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况
【答案】B
【解析】反应X2(g)+2Y2(g)2XY(g)△H<0,正反应为体积减小的放热的反应。A.加入催化剂,正、逆反应速率同等程度增大,平衡不移动,图像与实际不相符,故A错误;B.升高温度,反应速率加快,到达平衡时间缩短,平衡向逆反应方向移动,平衡时XY2的含量减小,图像与实际相符,故B正确,C.增大压强,反应速率加快,到达平衡时间缩短,平衡向正反应方向移动,平衡时XY2的含量增大,但图像中乙到达平衡时XY2的含量较小,与实际不符,故C错误;D.扩大体积,压强减小,正逆反应速率都降低,平衡向逆反应,逆反应速率降低较少,图像中平衡不移动,图像与实际不相符,故D错误;故选B。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】室温时,体积为1mL、浓度均为0.1mol·L-1的两种常见物质X(OH)n、K2AO3的溶液分別加水稀释至体积为VmL,pH随lgV的变化情况如下图所示。下列叙述错误的是( )
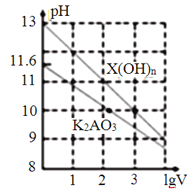
A. n=1
B. H2AO3的二级电离常数Ka2约为1.0×10-10.2
C. pH=10的两种溶液中水的电离程度相同
D. 升高温度,K2AO3溶液pH增大,X(OH)n溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列粒子:①BF3、②HCN、③NH2- 请填写下列空白(填序号):
(1)存在极性键的非极性分子是__________;
(2)中心原子轨道为sp3杂化的是________;
(3)只存在σ键的微粒是__________, 存在π键的微粒是__________,
(4)空间构型呈“V”形的是__________。
Ⅱ.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_______________,
(2)NH2-的电子式为__________________________,
(3)写出二种与N3-等电子体的微粒化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如下:
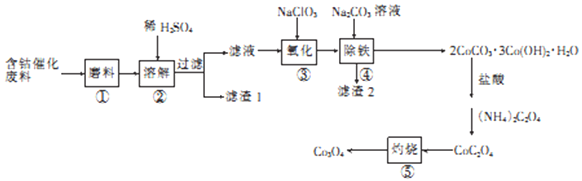
回答下列问题:
(1)CoC2O4中Co的化合价为_____。
(2)步骤②经溶解后过滤,滤渣1的主要成分为____(填化学式),滤液中含有_____种阳离子。
(3)步骤③氧化对Fe2+全部转化为Fe3+,反应的离子方程式为_______,检验其是否已完全氧化自方法是______________。
(4)步骤国加Na2CO3溶液的目的是_____________,滤渣2中含有Na2Fe6(S04)4(OH)x,则x=____,滤渣2中__________(填“含有”或“不含”Al(OH)3。
(5)某工厂用m1kg含钴催化剂废料Co2O3的质量分数为35%)制备Co3O4,最终得到产品m2kg,其产率为________(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g),体系中n(NO2)随时间的变化如表:
2NO2(g),体系中n(NO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)(mol) | 0.00 | 0.010 | 0.012 | 0.013 | 0.013 | 0.013 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K(350℃)300℃),则该反应是________(填吸或放)热反应。
(2)下图中表示NO的变化的曲线是_________(填字母)用O2表示从0~2 s内该反应的平均速率v=_________。
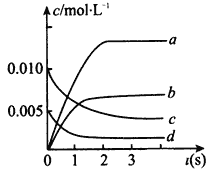
(3)能说明该反应已达到平衡状态的是______________(填字母)
A.c(NO2)=2c(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正(O2) D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有一包粉末状药品,可能由NaCl、 FeCl3 、 Al2(SO4)3中的一种或多种组成,某同学为确定其组成,进行如下实验(所加试剂均为过量)。请回答下列问题:
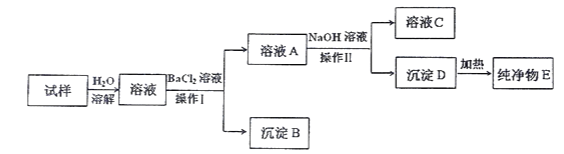
(1)操作Ⅰ的名称是___________。
(2)生产沉淀B的离子方程式为_________________________________。
(3)纯净物E是____________(填化学式,下同)。
(4)通过以上实验,确定该药品中一定含有______________,可能含有_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com