
【题目】下列物质中,主要成分不是硅酸盐的是( )
A.陶瓷
B.大理石
C.玻璃
D.水泥
科目:高中化学 来源: 题型:
【题目】图1和图2分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是

A. 图1中的每个小黑点表示1个电子
B. 图1中的小黑点表示某一时刻,电子在核外所处的位置
C. 图2表示1s电子只能在球体内出现
D. 图2表明1s轨道呈球形,有无数对称轴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途。回答下列问题:
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液: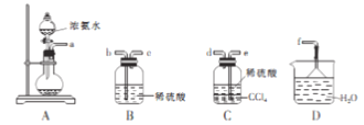
(1)用装置A制备氨气时,检验a处是否有氨气产生的方法是____________________。
(2)制取(NH4)2SO4 溶液时仪器连接的顺序(用接口字母和箭号“→”表示)是a→______________(所选装置不重复使用)。
(3)将装置C中两种液体分离,所需的主要玻璃仪器是______________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用用氢氧化镁热分解氯化铵制干燥氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
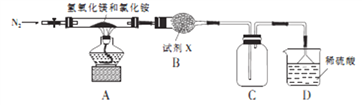
(4)氯化铵的电子式为_________________,装置A中发生反应生成碱式氯化镁的化学方程式为_____________________。
(5)装置B中试剂X为_______________________。
(6)上述装置图中有一处错误,请指出改正的方法:_______________________。
(7)MgCl2·6H2O在空气中加热,生成Mg(OH)Cl,若由MgCl2·6H2O制备无水MgCl2,实验方法为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于镍粉的制造,其中一种生产工艺如下(已知还原性:Fe2+>Ni2+):
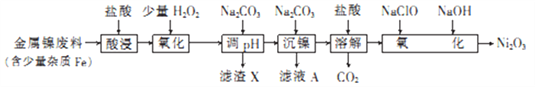
回答下列问题:
(1) Ni2O3中Ni 的化合价为________________。
(2)为了提高金属镍废料浸出速率,在“酸浸”时可采取的措施有_______________________(写两条)。
(3)若将H2O2溶液改为酸性KMnO4溶液(在该实验条件下,Ni2+不能被KMnO4氧化),则“氧化”过程中的离子方程式为_______________________;加入Na2CO3溶液调pH,产生的“滤渣X”是_____________。
(4)从滤液A中可回收利用的主要物质是___________________;加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为_________________________。
(5)工业上用镍为阳极,电解0.05~0.1mol·L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl 的浓度对阴极电流效率及镍的成粉率的影响如下图所示:
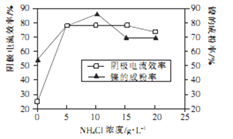
①NH4Cl浓度最好控制为____________g·L-1。
②当NH4Cl浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,相应的电极反应式
为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( )

A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅲ是升高温度的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢气是一种清洁能源,其来源可以是:
途径1.用太阳能分解水生成氢气 途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
已知:在25℃、101kPa时 2CO(g)+ O2 (g) ===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。补全该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH =_________
(2)已知拆开与形成1mol化学键需要相同的能量,途径2中,拆开1mol H-H键需能量是ckJ、1molH-O键是bkJ、1mol C-H键是akJ,则拆开1mol CO(g)化学键需要能量是_______kJ (用含字母的式子表示)
(3)CH4燃烧生成CO2和气态H2O的热化学方程式为__________
II.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。
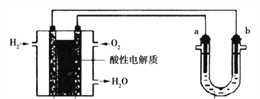
(4)燃料电池工作时,正极反应为:______________。
(5)U型管中装CuSO4溶液时,a、b两极均是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积比是:________。
(6)U型管中装饱和NaCl水溶液时,电解总反应的离子方程式是______________。
(7)用惰性电极电解M(NO3)x的水溶液,当阴极上增重m克时,在阳极上同时产生nL氧气(标准状况),从而可知M的相对原子质量是_________。(用含字母的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氯元素全部被氧化的是( )
A. 2P+3Cl2![]() 2PCl3
2PCl3
B. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. NaOH+HClNaCl+H2O
D. 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com