
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵����ȷ����
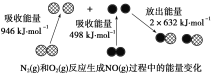
A.1 mol N2��g����NA�� O2��g����Ӧ�ų�������Ϊ180 kJ
B.1 mol N2��g����1 mol O2��g�������������2 mol NO��g�����������
C.ͨ������£�N2��g����O2��g�������ֱ������NO
D.NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ
���𰸡�B
��������
A. �ʱ�=��Ӧ�����֮��-���������֮�ͣ���N2(g)+O2(g)=2NO(g) ��H=946kJ/mol+498kJ/mol-2��632kJ/mol=180kJ/mol>0����Ӧ�����ȷ�Ӧ����A����
B. ����A�����֪��Ӧ�����ȷ�Ӧ�����������غ㣬1 mol N2(g)��1 mol O2(g)���е�������С��2 mol NO(g)���е�����������B��ȷ��
C. ͨ������£�N2(g)��O2(g)��ϲ���ֱ������NO����C����
D. NO�Dz����������������NaOH��Һ��Ӧ�����κ�ˮ����D����
��ѡB��


 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�� A 0.02mol �������г��ȼ�պ�����������ͨ��Ũ����ͼ�ʯ�ң�Ũ������������ 1.44g�� ��ʯ������ 3.52g
(1)�� A �ķ���ʽΪ_____
(2)�� A ȼ�յĻ�ѧ����ʽΪ_
(3)���� A ��ʹ��ˮ��ɫ���ڴ����������� H2 �ӳɣ���ӳɲ�������к��� 3 �������� A �Ľṹ��ʽΪ_____���� A ��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Է�������Ϊ72���������������Ľṹ��ʽΪ___��
��2������Ľṹ��ʽΪ___����ϩ�ĵ���ʽΪ___��
��3������ķ���ʽΪ__������ʽΪ__��
��4����ϩ�������ӳɷ�Ӧ����ʽ___��
��5������Һ��ȡ����Ӧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. ����Ķ���ȡ������3��
B. ![]() �ͱ���ϩ��Ϊͬϵ��
�ͱ���ϩ��Ϊͬϵ��
C. ����(NH4)2SO4��Һ�������־���ʹ��������Һ������������ԭ����ͬ
D. �ۺ���(![]() )���ɵ���CH3CH��CH2��CH2��CH2�Ӿ��Ƶ�
)���ɵ���CH3CH��CH2��CH2��CH2�Ӿ��Ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������ɳ����ԭ�����͵���
A.ʵ�������ű���ʳ��ˮ�ķ����ռ�![]()
B.���Ṥҵ�У�ʹ�ù����Ŀ�������߶��������ת����
C.�ϳɰ���ҵ�У���ʱҺ������![]() ����ѭ������δ��Ӧ���
����ѭ������δ��Ӧ���![]() ��
��![]()
D.�ϳɰ���ҵ�У�500��ȳ��¸������ڰ��ĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��g��+5B��g��![]() 4C��g��+6D��g������5 L���ܱ������н��У�����Ӻ�C�����ʵ���������0.30 mol������������ȷ���ǣ�������
4C��g��+6D��g������5 L���ܱ������н��У�����Ӻ�C�����ʵ���������0.30 mol������������ȷ���ǣ�������
A. A��ƽ����Ӧ������0.010 molL��1s��1
B. �����к�D���ʵ�������Ϊ0.45 mol
C. ������A��B��C��D�����ʵ����ı�һ����4��5��4��6
D. ������A�����ʵ���һ��������0.30 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���¶ȵ���570��Cʱ����ԭ������ˮ������Ӧ�IJ�����FeO������570��Cʱ������Fe3O4����ʦ����ͼ��ʾʵ��װ�ã�����˻�ԭ������ˮ������Ӧ����ʾʵ�顣

��ͬѧΪ̽��ʵ����Թ��ڹ���ijɷ֣�����������ʵ�飺

�Իش��������⣺
(1)ʪ����������_______________________________________________________ ��
(2)д������570��Cʱ��Fe��ˮ������Ӧ�Ļ�ѧ����ʽ��______________________________________��
(3)��ͬѧ��Ϊ����KSCN��Һû�г���Ѫ��ɫԭ������ǹ�����û��Fe3O4��Ҳ�п�������Ϊ______(����������)������ɵġ������ʹ���ʱ����Һ�л��ᷢ����Ӧ�����¼���KSCN��Һʱû�г���Ѫ��ɫ���÷�Ӧ�����ӷ���ʽ��___________________________________________________��
(4)��ͬѧ��������ʵ��ټ���������Һ��ȡ��ɫ��Fe(OH)2����������Һ�м�������NaOH��Һ�۲쵽��ʵ������Ϊ_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�����仯�����ڿ�ѧ�о��к�ҵ�����о���������;��
��1����̬��ԭ�ӵĺ���۵����Ų�ʽΪ________��
��2������+2��+3��+4��+5�ȼ��ֻ��ϼۡ��⼸�ּ�̬�У����ȶ�����______��
��3��V2O5�ܽ���NaOH��Һ�У��ɵõ������ƣ�Na3VO4����������VO43-�ռ乹����ͬ��һ��������__________���ѧʽ����
��4����������������[V��CN��6]4-��[V��H2O��6]2+�ȡ�
��CN-��N2��Ϊ�ȵ����壬CN-��������������Ŀ��Ϊ________��
�ڶ�H2O��V2+�γ�[V��H2O��6]2+���̵���������������______________��
a.��ԭ�ӵ��ӻ����ͷ����˱仯
b.���Ļ�ѧ���ʷ����˸ı�
c.������������H��O���ļнǷ����˸ı䡣
d.H2O��V2+֮��ͨ�����»������ϡ�
����[V��H2O��6]2+�д��ڵĻ�ѧ����___________��
a.������ b.��� c. ���� d.���� f. ���
��5����֪���ʷ��ľ�����ͼ����Vԭ�ӵ���λ����_______�����辧���ı߳�Ϊd nm���ܶ��� g��cm-3�������ԭ������Ϊ_______________�����谢��٤������ΪNA��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦX(g)![]() 4Y(g)+Z(g)����200���T��ʱ��X �����ʵ���Ũ��(��λ��mol��L-1)��ʱ��� �����й�ʵ�����ݼ��±���
4Y(g)+Z(g)����200���T��ʱ��X �����ʵ���Ũ��(��λ��mol��L-1)��ʱ��� �����й�ʵ�����ݼ��±���
ʱ��/min | 0 | 2 | 4 | 6 | 8 | 10 |
200/�� | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
T/�� | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
�����йظ÷�Ӧ��������ȷ����
A. ��200��ʱ��4min����Y��ʾ�Ļ�ѧ��Ӧ����Ϊ0.1125mol��L-1��min-1
B. T���£�6minʱ��Ӧ�պôﵽƽ��״̬
C. �����ϱ��� X ��Ũ�ȱ仯����֪Ũ��Խ��Ӧ����Խ��
D. �ӱ��п��Կ���T <200
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com