
【题目】某烃 A 0.02mol 在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加 1.44g, 碱石灰增重 3.52g
(1)烃 A 的分子式为_____
(2)烃 A 燃烧的化学方程式为_
(3)若烃 A 能使溴水褪色,在催化剂作用下与 H2 加成,其加成产物分子中含有 3 个甲基,则 A 的结构简式为_____;烃 A 与溴的四氯化碳溶液反应的化学方程式为_____
【答案】C4H8 C4H8+6O2![]() 4CO2+4H2O (CH3)2C=CH2 (CH3)2C=CH2+Br2 → BrC(CH3)2CH2Br
4CO2+4H2O (CH3)2C=CH2 (CH3)2C=CH2+Br2 → BrC(CH3)2CH2Br
【解析】
(1)~(2)某烃 A 0.02mol,燃烧产物中,使浓硫酸质量增加 1.44g,则n(H2O)=![]() =0.08mol,碱石灰增重3.52g,则n(CO2)=
=0.08mol,碱石灰增重3.52g,则n(CO2)=![]() =0.08mol,由此可求出1molA完全燃烧生成H2O4mol、CO24mol,从而得出A的分子式,并能写出燃烧反应方程式。
=0.08mol,由此可求出1molA完全燃烧生成H2O4mol、CO24mol,从而得出A的分子式,并能写出燃烧反应方程式。
(3)烃A能使溴水褪色,则为烯烃,与 H2加成产物分子中含有3个甲基,则A分子内应含有2个甲基,由此可得出A的结构简式,并能写出与溴的四氯化碳溶液反应的化学方程式。
(1) n(H2O)=![]() =0.08mol,n(CO2)=
=0.08mol,n(CO2)=![]() =0.08mol,n(A)= 0.02mol,则1molA完全燃烧生成H2O4mol、CO24mol,从而得出A的分子式为C4H8。答案为:C4H8;
=0.08mol,n(A)= 0.02mol,则1molA完全燃烧生成H2O4mol、CO24mol,从而得出A的分子式为C4H8。答案为:C4H8;
(2) C4H8燃烧生成二氧化碳和水,燃烧反应方程式为C4H8+6O2![]() 4CO2+4H2O。答案为:C4H8+6O2
4CO2+4H2O。答案为:C4H8+6O2![]() 4CO2+4H2O;
4CO2+4H2O;
(3)烃A能使溴水褪色,则为烯烃,与 H2加成产物分子中含有3个甲基,则A分子内应含有2个甲基,由此可得出A的结构简式为(CH3)2C=CH2,与溴的四氯化碳溶液反应,生成BrC(CH3)2CH2Br,化学方程式为(CH3)2C=CH2+Br2 → BrC(CH3)2CH2Br。答案为:(CH3)2C=CH2;(CH3)2C=CH2+Br2 → BrC(CH3)2CH2Br。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
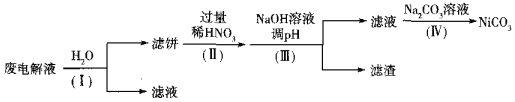
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:2H2(g) + O2(g) = 2H2O(1) ΔH= -571.6 kJmol-1,C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O(l) ΔH= -2220 kJmol-1,下列说法正确的是( )
A.相同质量H2和C3H8分别完全燃烧,C3H8放出的热量多
B.C3H8 完全燃烧生成1mol H2O(l)放出的热量为555 kJ
C.l mol H2和2 molC3H8 组成的混合气体完全燃烧放出的热量为5011.6 kJ
D.H2和C3H8的混合气体共4mol,完全燃烧时放出3256 kJ热量,则 n(H2):n(C3H8)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(![]() )废水,一定条件下,氯气和
)废水,一定条件下,氯气和![]() 反应生成无毒气体。下列说法不正确的是
反应生成无毒气体。下列说法不正确的是
A. ![]() 中碳元素的化合价为+2
中碳元素的化合价为+2
B. 该反应的产物之一是无毒的![]()
C. 当1mol![]() 参与反应时,转移
参与反应时,转移![]()
D. 处理含0.1mol![]() 的废水,理论上需要消耗标准状况下
的废水,理论上需要消耗标准状况下![]() 的体积为5.6L
的体积为5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
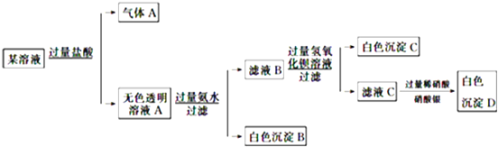
A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用浓硫酸和乙醇制取乙烯,并验证探究乙烯与溴反应。实验装置如下(省略夹持、搅拌、加热装置)。
装置1 装置2
装置2 
请回答:
(1)仪器b的名称是_________;
(2)加热前,需将乙醇和浓硫酸混合。仪器a中盛装的是_________;
(3)乙醇制取乙烯的化学反应方程式为_________________;
(4)实验结果讨论:①甲同学观察到装置1中溴水颜色褪去,认为乙烯与溴水发生加成反应。化学反应方程式为____;
②乙同学观察到反应混合液逐渐变黑,认为乙烯中可能混有一种还原性气体,它也能使溴水颜色褪去。为证明乙烯能使溴水褪色,需将装置1虚线部分换成装置2,重做实验。装置2中,C所盛试剂是___;
③丙同学认为甲同学在观察实验现象时,漏掉一个能够证明乙烯与溴水发生了反应的重要实验现象。该现象是指_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y、Z为原子序数依次增大的短周期主族元素,M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,Y和M形成的一种化合物是引起酸雨的主要大气污染物,X的原子核外有3个单电子。请回答下列问题:
(1)R基态原子的电子排布式是______________,X、Y、Z电负性由小到大的顺序是_______(填元素符号)
(2)Y的氢化物在乙醇中的溶解度小于M的氢化物,其原因是______________
(3)在 H2O分子中,H﹣O﹣H的键角是_________,H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角________填“大、小、相等”),原因为________________________________
(4)Y与M形成的YM3分子的空间构型是____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
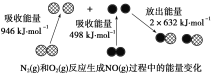
A.1 mol N2(g)和NA个 O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com