
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
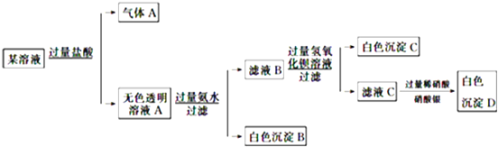
A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
【答案】C
【解析】
某溶液加入过量的盐酸后产生气体,说明有碳酸根离子,则钡离子铁离子和铜离子都不存在,溶液A加入过量的氨水产生白色沉淀,则说明原溶液中有偏铝酸根离子,沉淀为氢氧化铝,滤液B加入过量的氢氧化钡产生白色沉淀,说明原溶液中有硫酸根离子,滤液C加入过量的稀硝酸和硝酸银,产生白色沉淀,因为最初加入盐酸,不能说明原溶液中是否有氯离子。
A.通过分析可知,原溶液中一定有偏铝酸根离子,碳酸根离子,硫酸根离子,钠离子,不能确定氯离子,故错误;
B.气体A的化学式是CO2,其电子式为![]() ,故错误;
,故错误;
C.通过分析可知原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故正确;
D.生成沉淀B的离子方程式为:Al3++3NH3H2O===Al(OH)3↓+3NH4+,故错误。
正确选项C。


科目:高中化学 来源: 题型:
【题目】气体A的产量可以衡量一个国家石油化工发展水平。如图是由A为原料生产B的转化关系图,B是一种有香味的液体。
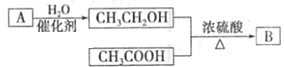
(1)将A通入溴水中,反应方程式__________________________(有机物写结构简式)观察到的实验现象是__________,A分子中官能团是_______。(写名称)
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_________________________,反应类型________
(3)1mol的乙酸与足量的乙醇反应,得到的乙酸乙酯66g,则产率为___________
(4)写出乙醇的一种用途:____________ ;乙烯的一种用途:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
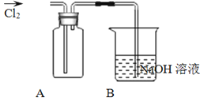
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 4NH3(g)+5O2(g) 4NO(g) +6H2O(g) ΔH= - a kJ·mol-l (a>0),一定条件下在容积为5L的密闭容器中投入1 mol NH3 和 1mol O2,2min 末 NO 的物质的量增加了 0.4 mol,下列说法正确的是( )
A.2min时反应放出的热量等于 0.l a kJ
B.用氧气表示2min 内的平均反应速率:v(O2)=0.25 mol·L-1·min-1
C.2min内,NH3 的转化率小于O2的转化率
D.2min末,c(H2O)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐,难溶于乙醇,常用于定量分析。某实验小组利用工业废铁屑制取摩尔盐,并测定其纯度,工艺流程图如下。
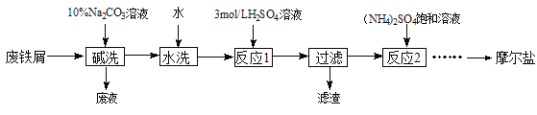
已知:硫酸铵、FeSO4·7H2O、硫酸亚铁铵在水中的溶解度
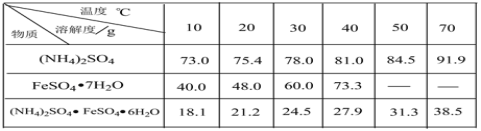
(1)碱洗的目的是_________。
(2)反应1温度需控制在70~75℃,可采取的措施是________。
(3)反应2中常用3 mol·L-1的硫酸调节溶液的pH为1~2,其目的是_______。
(4)请补充完整由反应2所得溶液获得硫酸亚铁铵晶体的实验方案:____、过滤、用乙醇洗涤、低温干燥。
(5)为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,做了如下实验:
准确称取0.4000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.0100 mol·L-1 标准KMnO4溶液滴定,当MnO![]() 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
请回答下列问题:
①滴定终点的现象为____________。
②上述样品中(NH4)2SO4·FeSO4·6H2O晶体(相对分子质量为392)的质量分数为______。
③在上述方案的基础上,下列措施能进一步提高测定准确度的有_____(填字母)。
A.适当增加称量样品的质量 B.用盐酸替代H2SO4溶液
C.用酚酞做指示剂 D.多次实验,取平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 0.02mol 在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加 1.44g, 碱石灰增重 3.52g
(1)烃 A 的分子式为_____
(2)烃 A 燃烧的化学方程式为_
(3)若烃 A 能使溴水褪色,在催化剂作用下与 H2 加成,其加成产物分子中含有 3 个甲基,则 A 的结构简式为_____;烃 A 与溴的四氯化碳溶液反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质,请按要求将序号填入下列空格内
A.35Cl和37Cl B.C60和石墨 C.![]() 和
和![]() D.异丁烷和2-甲基丙烷 E.CH2=CH-COOH和油酸(C17H33COOH)
D.异丁烷和2-甲基丙烷 E.CH2=CH-COOH和油酸(C17H33COOH)
(1)互为同位素的是________________;
(2)互为同系物的是_________________;
(3)互为同分异构体的是_____________;
(4)属于同一物质的是_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒沙特列原理解释的是
A.实验室用排饱和食盐水的方法收集![]()
B.硫酸工业中,使用过量的空气以提高二氧化硫的转化率
C.合成氨工业中,及时液化分离![]() ,并循环利用未反应完的
,并循环利用未反应完的![]() 和
和![]()
D.合成氨工业中,500℃比常温更有利于氨的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com