
����Ŀ����������茶���[(NH4)2SO4��FeSO4��6H2O]�ֳ�Ħ���Σ��������Ҵ��������ڶ���������ijʵ��С�����ù�ҵ����м��ȡĦ���Σ����ⶨ�䴿�ȣ���������ͼ���¡�
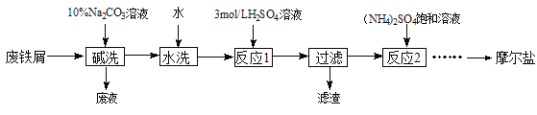
��֪������李�FeSO4��7H2O�������������ˮ�е��ܽ��
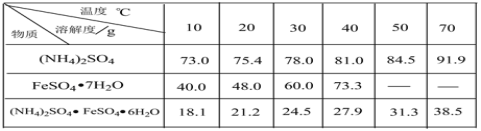
(1)��ϴ��Ŀ����_________��
(2)��Ӧ1�¶��������70~75�棬�ɲ�ȡ�Ĵ�ʩ��________��
(3)��Ӧ2�г���3 mol��L-1�����������Һ��pHΪ1��2����Ŀ����_______��
(4)�벹�������ɷ�Ӧ2������Һ�����������茶����ʵ�鷽����____�����ˡ����Ҵ�ϴ�ӡ����¸��
(5)Ϊ�ⶨ���������(NH4)2SO4��FeSO4��6H2O���崿�ȣ���������ʵ�飺
ȷ��ȡ0.4000g������������茶���������ƿ���ܽ⣬������ϡ�����ữ����0.0100 mol��L��1 ��KMnO4��Һ�ζ�����MnO![]() ǡ����ȫ����ԭΪMn2+ʱ������KMnO4��Һ�����Ϊ20.00 mL��
ǡ����ȫ����ԭΪMn2+ʱ������KMnO4��Һ�����Ϊ20.00 mL��
��ش��������⣺
�ٵζ��յ������Ϊ____________��
��������Ʒ��(NH4)2SO4��FeSO4��6H2O����(��Է�������Ϊ392)����������Ϊ______��
�������������Ļ����ϣ����д�ʩ�ܽ�һ����߲ⶨȷ�ȵ���_____������ĸ����
A���ʵ����ӳ�����Ʒ������ B�����������H2SO4��Һ
C���÷�̪��ָʾ�� D�����ʵ�飬ȡƽ��ֵ
���𰸡���ȥ���� ˮԡ���� ����ˮ�� ����Ũ������ȴ�ᾧ ��ɫ��Ϊdz��ɫ���Ұ�����ڲ��ٻָ�ԭɫ 98.0% AD
��������
����м�м���10%��̼������Һϴ��������֬��Ȼ����ˮϴ��մ����м�����̼���ƣ�����ϡ���ᣬˮԡ�����Ʊ�����������Һ��Fe+H2SO4=FeSO4+H2����Ϊ�˷�ֹ�������ӱ�������������м����������˳�����������м����Һ�м��뱥���������Һ��Ϊ����������������笠�����ˮ�⣬�����pH=1��2������Ũ������ȴ�ᾧ�����˼���Ħ���Ρ�
(1)��м�������һ���Ͳ�,̼������ҺΪ������Һ,��Ҫʹ����ϴ����м������ͣ�
�𰸣���ȥ����
(2)���µ���100�棬�ɲ�ȡ�Ĵ�ʩ��ˮԡ���ȣ���ʹ���Ⱦ��ȣ��¶��أ�
�𰸣�ˮԡ����
(3)��������狀�����������Ϊǿ�������Σ��������pHΪ1��2����ˮ�⣻
�𰸣�����ˮ��
(4)�����ܽ�ȱ���֪��������淋��ܽ�����¶����߶���������Ӧ�ò��ü���Ũ������ȴ�ᾧ�����ˡ����Ҵ�ϴ�ӡ����¸���ķ�ʽ��ã�
�𰸣�����Ũ������ȴ�ᾧ
(5)����KMnO4��Һ���еζ�������Ӧʱ���������Һ������������Ϊ�����ӣ���Ӧ�����ӷ���ʽΪ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O���жϴﵽ�ζ��յ�������ǵ����һ�����Ը�����ر���Һ����ʱ����ƿ����Һ�ɻ�ɫ��Ϊdz��ɫ���Ұ�����ڲ��ٻָ�ԭɫ��˵���ﵽ�ζ��յ㣻���õ�ʧ��������Ƚ��м��㣻�ʵ���߳�����Ʒ�����������ݹ����ܽ�һ����߲ⶨȷ�ȣ�����ƽ������ȡƽ��ֵ�ܽ�һ����߲ⶨȷ�ȣ�
�ٻ�ɫ��Ϊdz��ɫ���Ұ�����ڲ��ٻָ�ԭɫ��
����0.4000g�����к�(NH4)2SO4��FeSO4��6H2O������Ϊxg��
���ݵ�ʧ��������ȿ�֪��
5��(NH4)2SO4��FeSO4��6H2O�ݡ�KMnO4
5��392g 1mol
xg 0.0100mol/L��20.00��10-3L
��x=0.392g
��������Ϊ![]() =98.0%��
=98.0%��
��A.�ʵ����ӳ�����Ʒ������,���ݹ����ܽ�һ����߲ⶨȷ��,��A��ȷ��
B.���������H2SO4��Һ��������ػ�����ᷴӦ����B����ȷ��
C.�÷�̪��ָʾ����������к͵ζ�ָʾ����������������ԭ��Ӧ������û��Ҫ��ָʾ������C ����ȷ;
D.���ʵ�飬ȡƽ��ֵ�ܽ�һ����߲ⶨȷ�ȣ���D��ȷ��
�𰸣���ɫ��Ϊdz��ɫ���Ұ�����ڲ��ٻָ�ԭɫ 98.0% AD



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ڼӳɷ�Ӧ����( )
A. 2CH3CH2OH��O2![]() 2CH3CHO��2H2O
2CH3CHO��2H2O
B. CH2===CH2��HBr�D��CH3CH2Br
C. CH3CH2OH��CH3COOH![]() CH3COOCH2CH3��H2O
CH3COOCH2CH3��H2O
D. CH4��Cl2![]() CH3Cl��HCl
CH3Cl��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ�һ���֣��г��˾���Ԫ�������ڱ��е�λ��:
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
���û�ѧ����ش���������
(1)������Ԫ���У���������ǿ����____________��
(2)�١�����Ԫ������������Ӧ��ˮ������������ǿ����________�������ʻ�ѧʽ����д���͢������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ _______________________________��
(3)ֻ�ɢ��γɵ�18�������ĵ���ʽ _______________��
(4)д���ɢٺ͢��γɵ����ӻ�����Ļ�ѧʽ ____________________________��
(5)�õ���ʽ��ʾ�ߺ͢��γɵĻ�������γɹ���_________________________________��
(6)����Ԫ�آۺ͢ݿ��γ�һ����Է�������Ϊ66�Ĺ��ۻ�����Y��Y�����и�ԭ�Ӿ��ﵽ��8�����ȶ��ṹ����Y�Ľṹʽ _________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����������Ҫ�ɷ�ΪAl2O3��Fe2O3������������FeS2��Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ���������ͼ����������������ǣ� ��
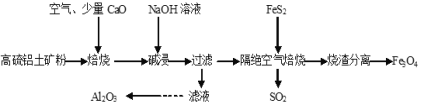
A.�����������ѡ���ô����������е�Fe3O4�������
B.������������ʱ�����Ϸ�Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1��5
C.����Һ��ͨ�����CO2�����ˡ�ϴ�ӡ����ճ������Ƶ�Al2O3
D.����CaO���Լ���SO2���ŷ�ͬʱ���ɽ�������CaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���Ի�ѧ��Ӧ���о�����ָ�����塣
��1�������������ŷ��ѳ�Ϊ���д�����Ⱦ����Ҫ��Դ������������NO�ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g) ��H ��0�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ�������������ܵ�ԭ��___________��_____________��
2NO(g) ��H ��0�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ�������������ܵ�ԭ��___________��_____________��
��2���ɽ��ʯTiO2��ȡ����Ti���漰���IJ���Ϊ��
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
��֪����Cs��O2g��CO2g�� H��3935 kJ��mol1
��2COg��O2g��2CO2g�� H��566 kJ��mol1
��TiO2s��2Cl2g��TiCl4s��O2g�� H��+141 kJ��mol1
��TiO2s��2Cl2g��2Cs��TiCl4s��2COg��H��________________��
��3��������298K��100kPaʱ����1Lˮ�п��ܽ�0.09mol��ʵ��������ˮ��Cl2Լ��1/3��ˮ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______��������ƽ����ϵ�м�������NaOH���壬��Һ��Cl��Ũ��_______��ѡ����������������С����������������
��4��һ�������£�Fe3+��I����ˮ��Һ�еķ�Ӧ��2I��+2Fe3+![]() I2+2Fe2+������Ӧ�ﵽƽ�����CCl4��������¶Ȳ��䣬����ƽ����_______��ѡ��������Ӧ�������淴Ӧ���������ƶ��������һ��ʹ�÷�Ӧ�Ļ�ѧƽ�������ƶ���ʵ�鷽��_____��
I2+2Fe2+������Ӧ�ﵽƽ�����CCl4��������¶Ȳ��䣬����ƽ����_______��ѡ��������Ӧ�������淴Ӧ���������ƶ��������һ��ʹ�÷�Ӧ�Ļ�ѧƽ�������ƶ���ʵ�鷽��_____��
��5����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����á���ӦA��4HCl��O2![]() 2Cl2��2H2O
2Cl2��2H2O
��֪�������������·�ӦA�У�4 mol HCl���������ų�115.6 kJ��������
����.![]()
![]()
��д���������£���ӦA���Ȼ�ѧ����ʽ___________��
�ڶϿ�1 mol H��O����Ͽ�1 mol H��Cl�������������ԼΪ__________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
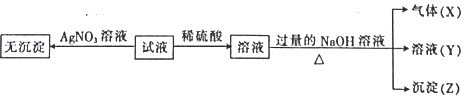
����Ŀ��ij��Һ��Na+��Cu2+��Ba2+��Fe3+��AlO![]() ��CO
��CO![]() ��SO
��SO![]() ��Cl�е�������������ɣ�ȡ��������Һ��������ʵ�飺����˵����ȷ����
��Cl�е�������������ɣ�ȡ��������Һ��������ʵ�飺����˵����ȷ����
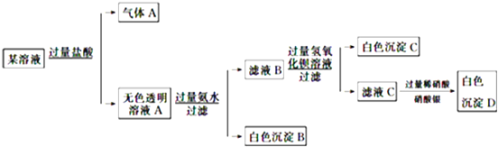
A. ԭ��Һ��һ��ֻ����![]() ��
��![]() ��
��![]() ��Cl-��������
��Cl-��������
B. ����A�Ļ�ѧʽ��CO2�������ʽΪO::C::O
C. ԭ��Һ��һ�������ڵ�������Cu2+��Ba2+��Fe3+
D. ���ɳ���B�����ӷ���ʽΪ��Al3++3OH===Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Fe2����I����Br������Һ��ͨ��������������Һ�����������ӵ����ʵ����������������ʵ����ı仯����ͼ��ʾ������˵������ȷ����(����)
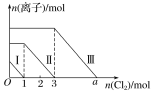
A.�߶�������Fe2���ı仯���
B.�߶�������Br���ı仯���
C.aֵ����6
D.ԭ�����Һ��n(FeBr2)��4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ɫ��Һ�п��ܺ��±������е����������ӡ�
������ | Mg2+��NH4+��Ba2+��Al3+��Fe2+ |
������ | SiO32-��MnO4-��Cl-��NO3-��SO32- |
ʵ��I ��ȡ��������Һ��������ʵ�顣
ʵ������Ϊ�˽�һ��ȷ������Һ����ɣ�ȡ100 mLԭ��Һ�������Һ�еμ�1 mol L-l�� NaOH��Һ����������������������������Һ����Ĺ�ϵ��ͼ��ʾ��

�ش��������⣺
��1��������ʵ��Ϳ����ƶϳ����ϱ��е�����һ�������ڵ���___________����
��2��ͨ��ʵ��I����ȷ������Һ��һ�����ڵ���������_____________����������X�ķ�����______________________������Z�Ļ�ѧʽΪ_________________��
��3��д��ʵ������ͼ����BC�ζ�Ӧ�����ӷ���ʽ��_____________________________________��
��4�� A���Ӧ�Ĺ�������Ϊ__________g��
��5��ͨ��������Ϣ���������Һ�������ӵ�Ũ��Ϊ______________mol L-l��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ�е�������HCl��SnCl2��H2SnCl6��As��H3AsO3��H2O����֪��HCl�Ƿ�Ӧ��֮һ��As��������֮һ��
��1����д��δ��ƽ�ĸ÷�Ӧ�Ļ�ѧ����ʽ��_________________________
���ڸ÷�Ӧ�У��õ��ӵ�������__________����������Ԫ����____________��
���ڷ�Ӧ�У�ÿת��1 mol���ӣ�����HCl________mol��
����������������ȷ����_____________________(��д��ĸ���)��
a.����ͬ�����£��ڢ�A��Ԫ�ص������ӵĻ�ԭ�Դ��ϵ�������ǿ
b.�õ���Խ�������������������Խǿ
c.������ֻ����������
d.����ͬ�����£�������˳��Fe3+>Cu2+>H+>Fe2+
��2������ʢ��KI��Һ���Թ��м�������CCl4��μ���ˮ��CCl4������ɫ���÷�Ӧ�����ӷ���ʽΪ_________________________������������Թ��еμ���ˮ����CCl4�����dz���������ɫ���÷�Ӧ�Ļ�ѧ����ʽΪ____________________��
�ڰ�KI����KBr����CCl4���Ϊ_______________ɫ�������μ���ˮ��CCl4�����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳����___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com