
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
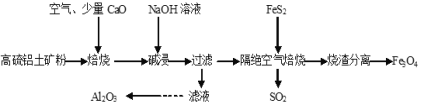
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
【答案】B
【解析】
由流程可知,高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,通入空气焙烧时,因为含有少量FeS2,会产生二氧化硫,加入氧化钙达到吸收二氧化硫的目的,防止二氧化硫排放污染空气,焙烧产物经过氢氧化钠溶液碱浸,三氧化二铝与氢氧化钠反应生成偏铝酸钠,过滤后,滤液中通入过量二氧化碳,偏铝酸根与二氧化碳、水反应生成氢氧化铝沉淀,洗涤后灼烧氢氧化铝即可生产三氧化二铝;碱浸过程中,三氧化二铁不与氢氧化钠反应,过滤后留在滤渣中,加入FeS2与三氧化二铁在隔绝空气的条件下反应生成二氧化硫和四氧化三铁,利用四氧化三铁的磁性实现其与烧渣的分离。据此分析解答。
A.Fe3O4有磁性,可以用磁铁将Fe3O4从烧渣中分离出来,故A正确;
B.隔绝空气焙烧,FeS2与Fe2O3反应,生成SO2和Fe3O4,反应方程式为:FeS2+16Fe2O3 ![]() 11Fe3O4+2SO2↑,由方程式可知n(FeS2)∶n(Fe2O3)=1∶16,故B错误;
11Fe3O4+2SO2↑,由方程式可知n(FeS2)∶n(Fe2O3)=1∶16,故B错误;
C.滤液中含有AlO2-,通入过量CO2,发生反应:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-,生成Al(OH)3沉淀,经过过滤、洗涤后得到Al(OH)3,再灼烧Al(OH)3,反应为:2Al(OH)3 ![]() +3H2O,即可制得Al2O3,故C正确;
+3H2O,即可制得Al2O3,故C正确;
D.铝土矿中含有FeS2,FeS2焙烧生成SO2,CaO与SO2、O2反应:2CaO+2SO2+O2=2CaSO4,CaSO4可用于建筑材料,故D正确;
故选B。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】实验室常用加热高锰酸钾的方法制取少量氧气。
(1)现在欲制取标准状况下1.12L氧气,需要消耗高锰酸钾________g;
(2)反应产生的MnO2经分离出来,与足量浓盐酸反应,其中被氧化的HCl的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中所示的物质转化过程中未涉及到氧化还原反应的是
A.Fe3O4![]() FeI2
FeI2![]() Fe(OH)2
Fe(OH)2
B.SiO2![]() Si
Si![]() SiCl4
SiCl4
C.NaCl![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D.SO2![]() H2SO4
H2SO4![]() Na2SO4
Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用如图所示的浓硫酸来配制步骤①中所需要的1mol/L的稀硫酸480ml,需要用这种浓硫酸的体积为______ml。

(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒、烧杯外还有_______、__________。
(3)下列操作会使所配溶液浓度偏低的是 _________。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度 E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①②③中,途径_________能更好地体现绿色化学的思想。
(5)配制1000ml 0.1mol/L的硫酸铜溶液,需用托盘天平称取________g胆矾。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苹果酸(![]() )的说法正确的是
)的说法正确的是
A. 1mol苹果酸与足量金属Na反应生成1molH2
B. 苹果酸可发生酯化反应,消去反应,缩聚反应
C. 苹果酸能与H2发生加成反应
D. 1mol苹果酸可与3molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92gFe和Fe2O3的混合物溶于200mL盐酸中,生成0.336L(标准状况下)氢气,向反应后的溶液中加入KSCN检验,溶液不显红色。为让溶液中的金属离子恰好完全沉淀,消耗了400mL0.750 mol/L的氢氧化钠溶液。则:
(1)产生的氢气中所含的分子数为___。
(2)混合物中Fe和Fe2O3的物质的量之比为___。
(3)盐酸的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下

下列叙述错误的是()
A. 步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C. 步骤(2)产物中残留的烯丙醇可用溴水检验
D. 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com