
【题目】1.92gFe和Fe2O3的混合物溶于200mL盐酸中,生成0.336L(标准状况下)氢气,向反应后的溶液中加入KSCN检验,溶液不显红色。为让溶液中的金属离子恰好完全沉淀,消耗了400mL0.750 mol/L的氢氧化钠溶液。则:
(1)产生的氢气中所含的分子数为___。
(2)混合物中Fe和Fe2O3的物质的量之比为___。
(3)盐酸的物质的量浓度为___mol·L-1。
【答案】0.015NA(或9.03×1021) 2:1 1.5
【解析】
将铁和氧化铁的混合物加入盐酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成氯化亚铁,为让溶液中的金属离子恰好完全沉淀,消耗了400mL0.750 mol/L的氢氧化钠溶液,而且使铁完全转化成氢氧化亚铁,
(1)生成0.336L(标准状况下)氢气,氢气的物质的量=![]() =0.015mol,则氢气的分子数为0.015NA(或0.015×6.02×1023=9.03×1021)
=0.015mol,则氢气的分子数为0.015NA(或0.015×6.02×1023=9.03×1021)
(2)只有铁和盐酸反应产生氢气,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成氯化亚铁;设原混合物中,Fe的物质的量为xmol,Fe2O3的物质的量为ymol,过程中发生的反应为:
Fe2O3+6HCl=2FeCl3+3H2O 2FeCl3+Fe=3FeCl2 Fe+2HCl=FeCl2+H2↑
1 2 2 1 1 1
y 2y 2y y x-y x-y
根据反应中各物质的关系和题中已知条件可得:x-y=0.015mol,56x+160y=1.92
解得:x=0.02mol,y=0.005mol
混合物中Fe和Fe2O3的物质的量之比=0.02mol:0.005mol =4:1,
答案为:4:1;
(3)消耗了400mL0.750的氢氧化钠溶液,物质的量=0.4L×0.750mol/L=0.3mol,根据铁元素守恒,亚铁离子的物质的量为0.01mol+0.005mol×2=0.02 mol, 0.02mol FeCl2与氢氧化钠溶液反应消耗氢氧化钠0.04mol,说明反应中盐酸过量,剩余的氢氧化钠中和过量的盐酸,因此过量的盐酸的物质的量=0.3 mol-0.04mol=0.26mol,根据反应方程式Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑,Fe和Fe2O3消耗盐酸的物质的量=2×0.02mol=0.04 mol,则盐酸总的物质的量为0.26mol+0.04mol=0.3mol,故盐酸的物质的量浓度为![]() mol·L-1。
mol·L-1。
答案为:1.5。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】白藜芦醇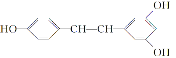 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
A. 白藜芦醇属于三元醇,能与Na反应产生H2
B. 能与NaOH反应,1 mol 该化合物最多能消耗NaOH 3 mol
C. 能使FeCl3溶液显色
D. 能与浓溴水反应,1 mol 该化合物最多能消耗溴6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
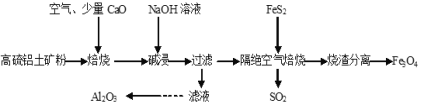
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,KHS溶液里存在下列平衡:a.HS-+H2O ![]() H3O++S2- b.HS-+H2O
H3O++S2- b.HS-+H2O![]() OH-+H2S。
OH-+H2S。
(1)平衡a是_______平衡(填“电离”或“水解”,下同),平衡b是_______平衡。
(2)向KHS溶液中加入少量NaOH固体,c(S2-)将__________(填“增大”、“减小”或“不变”,下同),向KHS溶被中通入HCl时,c(HS-)将__________。
(3)向KHS溶液中加入CuSO4溶液,有黑色沉淀(CuS)产生,则平衡a__________移动(填“正向”、“逆向”或“不”,下同),平衡b__________移动。
(4)在KHS溶液中,c(OH-)-c(H+)=____________________。
(5)向KHS溶液中加入AlCl3溶液,产生的现象为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的碱式盐X(四种元素组成的纯净物)进行了如下实验:
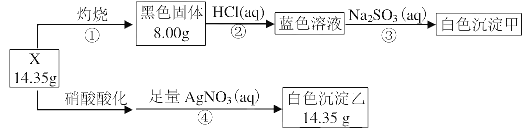
白色沉淀甲的组成元素与蓝色溶液的溶质相同,且组成的元素原子物质的量之比为1:1。请回答:
(1)X中含有的元素除了H、O之外,还含有的元素是___、____。
(2)白色沉淀甲的化学式是___,X的化学式是___。
(3)步骤③的离子方程式是___。
(4)在一定的温度下,将空气不断通入白色沉淀甲的悬浊液中可得到X,该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系,其中①②③均为有单质参与的反应。
![]()
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式________。
(2)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是______,写出反应①的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( )
A. 生成的乙酸乙酯中含有18O
B. 生成的水分子中不含有18O
C. 可能生成88 g乙酸乙酯
D. 可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右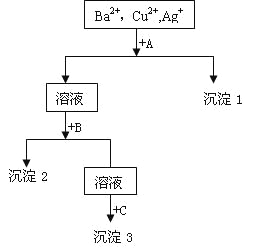
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A. CH2═CH﹣CH2﹣OHB. ![]()
C. CH2═CH﹣COOHD. CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com