
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。
【答案】Na HClO4 Al(OH)3 + OH- = AlO2- + 2H2O ![]() NH4H
NH4H ![]() F—N=N—F
F—N=N—F
【解析】
由元素在周期表中的位置可知,①②③④⑤⑥⑦⑧⑨分别为:H、C、N、O、F、Na、Mg、Al、Cl,据此解答。
(1)金属性最强的元素位于周期表中左下角,即Na,故答案为:Na;
(2)元素周期表中,所有元素的最高价氧化物对应的水化物酸性最强的是HClO4。⑥(Na)和⑧(Al)的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,二者反应的离子方程式为:Al(OH)3 + OH- = AlO2- + 2H2O,故答案为:HClO4;Al(OH)3 + OH- = AlO2- + 2H2O;
(3)④是O,只由O形成的18电子微粒是O22-,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)①是H,③是N,H和N都是非金属元素,二者形成的离子化合物必然有铵根,则该物质应为NH4H,故答案为:NH4H;
(5)⑦是Mg,⑨是Cl,二者形成MgCl2,MgCl2是离子化合物,其形成过程可表示为:![]() ,故答案为:
,故答案为:![]() ;
;
(6)Y中各原子均达到“8电子稳定结构”,③是N,最外层电子数为5,差3个电子稳定,则每个N原子必形成3对共用电子对,⑤是F,最外层电子数为7,差1个电子稳定,则每个F原子必形成1对共用电子对,其结构式必然为:F—N=N—F,故答案为:F—N=N—F。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.国产大飞机C919用到的氮化硅陶瓷属于新型无机非金属材料
B.用pH试纸测得氯水的pH为2
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.铝和重氢氧化钠的![]() 溶液反应的化学方程式:2Al+2NaOD+2
溶液反应的化学方程式:2Al+2NaOD+2![]() 2O=2NaAlO2+D2↑+
2O=2NaAlO2+D2↑+![]() 2↑
2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述错误的是
A. 如果硫原子核外电子排布图为![]() ,则违反了泡利原理
,则违反了泡利原理
B. 如果25号Mn元素的基态电子排布式为1s22s22p63s23p63d7,则违反了构造原理
C. 氮原子的核外电子排布图为![]() ,符合洪特规则和泡利原理
,符合洪特规则和泡利原理
D. 泡利原理、洪特规则、构造原理都是对核外电子排布满足能量最低的要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用过量铁片与稀硫酸反应制取氢气,采取下列措施:
①不用铁片,改用铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④将稀硫酸换为
固体;④将稀硫酸换为![]() 的硫酸;⑤加入
的硫酸;⑤加入![]() 固体;⑥向
固体;⑥向![]() 中通入HCl气体。 其中可提高
中通入HCl气体。 其中可提高![]() 生成速率的措施有
生成速率的措施有
A.①③④B.①③⑥C.②④⑤D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
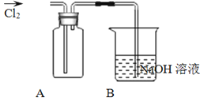
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
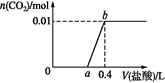
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
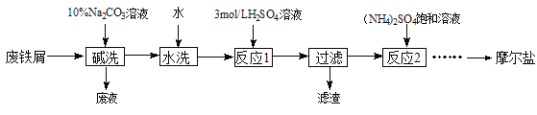
【题目】硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐,难溶于乙醇,常用于定量分析。某实验小组利用工业废铁屑制取摩尔盐,并测定其纯度,工艺流程图如下。
已知:硫酸铵、FeSO4·7H2O、硫酸亚铁铵在水中的溶解度
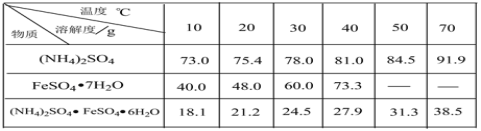
(1)碱洗的目的是_________。
(2)反应1温度需控制在70~75℃,可采取的措施是________。
(3)反应2中常用3 mol·L-1的硫酸调节溶液的pH为1~2,其目的是_______。
(4)请补充完整由反应2所得溶液获得硫酸亚铁铵晶体的实验方案:____、过滤、用乙醇洗涤、低温干燥。
(5)为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,做了如下实验:
准确称取0.4000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.0100 mol·L-1 标准KMnO4溶液滴定,当MnO![]() 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
请回答下列问题:
①滴定终点的现象为____________。
②上述样品中(NH4)2SO4·FeSO4·6H2O晶体(相对分子质量为392)的质量分数为______。
③在上述方案的基础上,下列措施能进一步提高测定准确度的有_____(填字母)。
A.适当增加称量样品的质量 B.用盐酸替代H2SO4溶液
C.用酚酞做指示剂 D.多次实验,取平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能由大到小的顺序是:________________(填元素符号),e的价层电子轨道示意图为__________________________________, e的焰色反应为亮绿色,请用原子结构的知识解释原因_____________________________
(2)a和b、c、d、e形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________;其中有两种分子,既含有极性共价键、又含有非极性共价键的化合物是_____________________(填化学式).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的两种酸是_____;请从物质结构与性质的关系解释,这两种酸酸性强弱的原因是______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com