
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能由大到小的顺序是:________________(填元素符号),e的价层电子轨道示意图为__________________________________, e的焰色反应为亮绿色,请用原子结构的知识解释原因_____________________________
(2)a和b、c、d、e形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________;其中有两种分子,既含有极性共价键、又含有非极性共价键的化合物是_____________________(填化学式).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的两种酸是_____;请从物质结构与性质的关系解释,这两种酸酸性强弱的原因是______________________________
【答案】N>O>S ![]() 电子从高能级跃迁回低能级,以光的形式释放能量 sp3 H2O2、N2H4 HNO2、HNO3 HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性越强
电子从高能级跃迁回低能级,以光的形式释放能量 sp3 H2O2、N2H4 HNO2、HNO3 HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性越强
【解析】
周期表前四周期的元素a、b、c、d、e原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,c的最外层电子数为其内层电子数的3倍,所以C是O元素,d与c同族,则d是S元素,b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素。
(1)同主族元素从上到下第一电离能减小,第一电离能O>S,同周期元素从左到右第一电离能增大,N原子2p轨道为半满状态,第一电离能大于相邻元素,第一电离能N>O,所以N、O、S中第一电离能由大到小的顺序是N>O>S,e是Cu元素,根据洪特规则,价层电子轨道示意图为![]() ;电子从高能级跃迁回低能级,以光的形式释放能量,所以铜的焰色反应为亮绿色;
;电子从高能级跃迁回低能级,以光的形式释放能量,所以铜的焰色反应为亮绿色;
(2)H和N、O、S形成的二元共价化合物有很多种,其中NH3分子呈三角锥形,该分子的N原子的杂化轨道数是![]() ,杂化方式为sp3;其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
,杂化方式为sp3;其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
(3)这些元素形成的含氧酸中,HNO2、HNO3分子的中心原子的价层电子对数为3;HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性更强。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
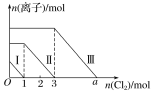
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
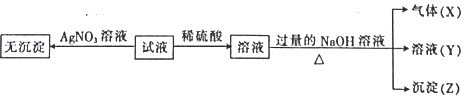
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
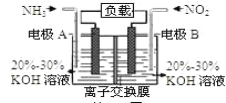
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
D.电极A极反应式为2NH3-6e-=N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
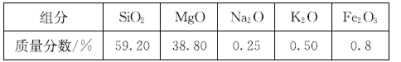
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
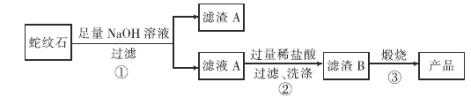
(1)蛇纹石中涉及的可溶性金属氧化物有 _______________________________ (写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为 _____________________________ 。
(3)滤渣A的成分有________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_________________________________________________ 。
(5)实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、_____________和_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一;As是生成物之一。
(1)①写出未配平的该反应的化学方程式:_________________________
②在该反应中,得电子的物质是__________,被氧化的元素是____________。
③在反应中,每转移1 mol电子,消耗HCl________mol。
④下列叙述中不正确的是_____________________(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为_________________________,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为____________________。
②把KI换成KBr,则CCl4层变为_______________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
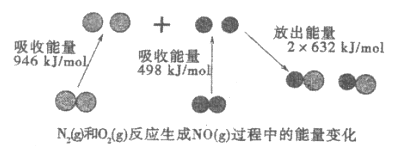
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com