
����Ŀ���ߴ��������������������ˡ�ij����ʯ�ijɷּ��±���
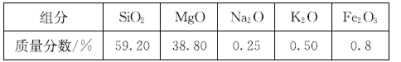
ͨ����ͼ���̿�������ʯ�Ʊ��ϴ����Ķ������衣
(1)����ʯ���漰�Ŀ����Խ����������� _______________________________ (д��ѧʽ)��
(2)��������漰SiO2��Ӧ�����ӷ���ʽΪ _____________________________ ��
(3)����A�ijɷ���________________(�ѧʽ)��
(4)�������ϴ�ӳ����ķ�����_________________________________________________ ��
(5)ʵ���ҽ��в������Ҫ�õ��������������������ǡ��ƾ��ơ���������_____________��_____________��
���𰸡�K2O ��Na2O SiO2 +2OH- = SiO32- + H2O MgO ��Fe2O3 ��©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�� ���ż� ����ǯ
��������
����ʯ���������������ƽ��ݣ����˵�AΪ��������Һ����������Һ�м����������ɹ�����������ˡ�ϴ�ӵ�����BΪ���ᣬ���չ���ɵö������衣
��1���ӱ��пɵó�������ʯ���漰�Ŀ����Խ�����������K2O ��Na2O���ʴ�Ϊ��K2O ��Na2O��
��2����������Ϊ������������������Ʒ�Ӧ���ɹ����ƺ�ˮ����������漰SiO2��Ӧ�����ӷ���ʽΪSiO2 +2OH- = SiO32- + H2O���ʴ�Ϊ��SiO2 +2OH- = SiO32- + H2O��
��3�������ơ������ؾ�����ˮ��Ӧ���ɿ����Լ��������Ϊ�������������������Ʒ�Ӧ���ɿ����Թ����ƣ�����þ���������������������Ʋ���Ӧ������A�ijɷ���MgO ��Fe2O3(�ѧʽ)���ʴ�Ϊ��MgO ��Fe2O3��
��4���������ϴ�ӳ����ķ�������©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�Ρ��ʴ�Ϊ����©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�Σ�
��5������ȶ������ֽ����ɶ��������ˮ������ʽ��H2SiO3![]() H2O+SiO2�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǡ��ʴ�Ϊ�����żܣ�����ǯ��
H2O+SiO2�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǡ��ʴ�Ϊ�����żܣ�����ǯ��


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
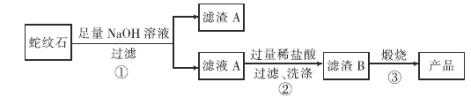
����Ŀ����NaOH��Na2CO3�����Һ�еμ�0.1 mol��L1ϡ���ᣬCO2����������������������Ĺ�ϵ��ͼ�������ж���ȷ����
A. ��0~a��Χ�ڣ�ֻ�����кͷ�Ӧ
B. ab�η�����Ӧ�����ӷ���ʽΪ��![]()
C. a=0.3
D. ԭ�����Һ��NaOH��Na2CO3�����ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
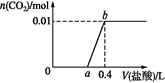
����Ŀ��ͼ1��ͭпԭ���ʾ��ͼ��ͼ2�У�x���ʾʵ��ʱ���������ĵ��ӵ����ʵ�����y���ʾ��������
A. ͭ�������� B. c(Zn2��) C. c(H��) D. c(SO42-) -
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3����d��cͬ�壻e�������ֻ��һ�����ӣ����������18�����ӣ��ش��������⣺
(1)b��c��d�е�һ�������ɴ�С��˳���ǣ�________________(��Ԫ�ط���)��e�ļ۲���ӹ��ʾ��ͼΪ__________________________________, e����ɫ��ӦΪ����ɫ������ԭ�ӽṹ��֪ʶ����ԭ��_____________________________
(2)a��b��c��d��e�γɵĶ�Ԫ���ۻ������кܶ��֣�������һ���ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ__________�����������ַ��ӣ��Ⱥ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������_____________________(�ѧʽ)��
(3)��ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3����������_____��������ʽṹ�����ʵĹ�ϵ���ͣ�������������ǿ����ԭ����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ����(�г�����δ����)��������

A. װ�â����ڼ�����������ȥ���ɵ���ϩ B. װ�â�����ʯ�͵ķ���
C. װ�â�����ʵ������������ D. װ�âܿ�֤�����ԣ����̼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ϵͳ������������������
��![]() __________________________
__________________________
�� _________________________
_________________________
��2���л��� ��ϵͳ������____�������ڴ������ڵ���������ȫ�⻯������������ϵͳ������ _______________________________________________��
��ϵͳ������____�������ڴ������ڵ���������ȫ�⻯������������ϵͳ������ _______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳɣ�
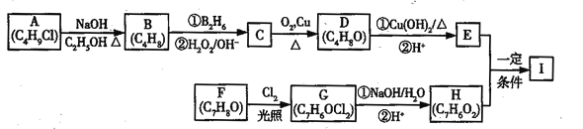
��֪������Ϣ��
��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��R��CH=CH2![]() R��CH2CH2OH��
R��CH2CH2OH��
�ۻ�����F�����ϵ�һ�ȴ���ֻ�����֣�
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______________________________��
��2��D�Ľṹ��ʽΪ_______________________________��
��3��E�еĹ���������Ϊ___________________________��
��4��F����G�Ļ�ѧ����ʽΪ__________________________���÷�Ӧ����Ϊ______________��
��5��I�Ľṹ��ʽΪ_________________________________��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ���������������ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������____�֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2:2:1��д��J������ͬ���칹��Ľṹ��ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̶����ܱ������з�����Ӧ��![]() �����������в���˵��������Ӧ�Ѵﵽ��ѧƽ��״̬����
�����������в���˵��������Ӧ�Ѵﵽ��ѧƽ��״̬����
A.���������ܶȲ���
B.��ϵ��ѹǿ����
C.��������ƽ����Է�����������
D.��Ӧ��ϵ���Ҵ������ʵ���Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȡ���ҵ����������(Al2O3��Fe2O3)Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������£�

��1�� �Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ____________________��
��2����Na2SO3��Һ�ɳ�ȥ��ȴ���ų���β���е�Cl2���˷�Ӧ�����ӷ���ʽΪ__________��
��3������������Ҫ����AlCl3��FeCl3�����������Al����������________��
��4��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ(������FeCl3)�Ĵ��ȣ���ȡ16.25 g��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�У����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ���������Ϊ0.32 g��
�� д���������ӹ������漰�����ӷ���ʽ___________��____________��
�� AlCl3��Ʒ�Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com