
【题目】(1)用系统命名法命名下列物质
①![]() __________________________
__________________________
② _________________________
_________________________
(2)有机物 的系统命名是____,将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是 _______________________________________________。
的系统命名是____,将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是 _______________________________________________。
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
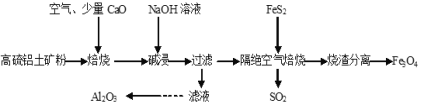
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
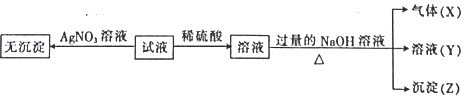
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
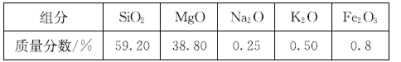
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
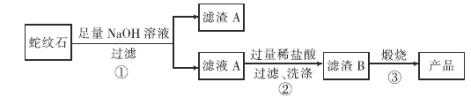
(1)蛇纹石中涉及的可溶性金属氧化物有 _______________________________ (写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为 _____________________________ 。
(3)滤渣A的成分有________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_________________________________________________ 。
(5)实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、_____________和_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写正确的是
![]()
A.C12+2OH-=Cl-+ClO-+2H2OB.Cu2++2OH-=Cu(OH)2↓
C.SO42-+Ba2+=BaSO4↓D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一;As是生成物之一。
(1)①写出未配平的该反应的化学方程式:_________________________
②在该反应中,得电子的物质是__________,被氧化的元素是____________。
③在反应中,每转移1 mol电子,消耗HCl________mol。
④下列叙述中不正确的是_____________________(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为_________________________,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为____________________。
②把KI换成KBr,则CCl4层变为_______________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
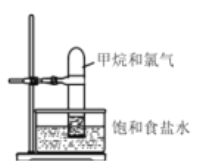
(1)油状液滴中属于非极性分子的电子式为________。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制________与水的反应。试管内液面上升的原因是________极易溶于水。
II.乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
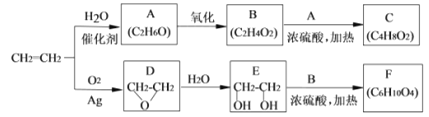
请回答下列问题:
(3)A的名称是________,含有的官能团名称是________。实验室A转化为乙烯的反应条件为________。
(4)B和A反应生成C的化学方程式为________,该反应的类型为________。
(5)F的结构简式为______________。
(6)写出D的同分异构体的结构简式__________________。
(7)乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。写出乙炔合成聚氯乙烯的合成路线。(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)______________
……目标产物)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、海水是可以综合利用的。从海水中提取食盐和溴的过程:

(1)请写出一种海水淡化的方法________________________。
(2)步骤Ⅰ获取Br2的离子方程式为_________________________________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是________(填化学式)。
Ⅱ、海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘的实验步骤:
①用剪刀剪碎海带,用酒精湿润,放入坩埚中。
②灼烧海带至完全成灰,停止加热,冷却。
③将海带灰加蒸馏水溶解,搅拌、煮沸、过滤。
④在滤液中滴加稀硫酸及过氧化氢,然后加入几滴淀粉溶液,(涉及反应的离子方程式为2I-+H2O2+2H+=I2+2H2O)。
能证明海带中含有碘的实验步骤是________(填序号),现象是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com