
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
【答案】A12O3+3C12+3C![]() A1C13+3COSO32-+C12+H2O═SO42-+2C1-+2H+;除去FeCl3;Fe3++3OH-=Fe(OH)3↓Al3++4OH-=[Al(OH)4]-96%;
A1C13+3COSO32-+C12+H2O═SO42-+2C1-+2H+;除去FeCl3;Fe3++3OH-=Fe(OH)3↓Al3++4OH-=[Al(OH)4]-96%;
【解析】
(1)根据制备AlCl3的工艺流程可知,由冷却器出来的气体有CO和Cl2,CO是氯化炉中的生成物,且Cl2是过量的,氯化炉中发生反应的化学方程式为Al2O3+3Cl2+3C![]() 2AlCl3+3CO;综上所述,本题答案是:A12O3+3C12+3C
2AlCl3+3CO;综上所述,本题答案是:A12O3+3C12+3C![]() A1C13+3CO。
A1C13+3CO。
(2) Na2SO3 与Cl2发生氧化还原反应,Na2SO3作还原剂被氧化为Na2SO4,Cl2作氧化剂,此反应的离子方程式为:SO32-+C12+H2O═SO42-+2C1-+2H+;综上所述,本题答案是:SO32-+C12+H2O═SO42-+2C1-+2H+。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,铝具有还原性,其作用是除去杂质FeCl3;综上所述,本题答案是:除去FeCl3。
(4)①无水AlCl3产品(含杂质FeCl3)溶于过量NaOH溶液涉及到的离子方程式为Fe3++3OH-===Fe(OH)3↓,Al3++4OH-===AlO2-+2H2O或Al3++4OH-=[Al(OH)4]-;因此本题答案是:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=[Al(OH)4]-。
②沉淀物经洗涤、灼烧、冷却、称量得到的0.32 g固体是氧化铁,n(Fe2O3)=0.32/160=0.002 mol,则n(FeCl3)=0.002 mol×2=0.004 mol,m(FeCl3)=0.004 mol×162.5 g/mol=0.65 g,则AlCl3的质量为16.25 g-0.65 g=15.6 g,AlCl3的纯度为15.6/16.25×100%=96%;综上所述,本题答案是:96%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为__。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为__,通入b气体的电极反应式__。(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在__左右。

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为__。
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则Y电极上的电极反应式为____________;
②如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,Y电极反应式为__________________(说明:杂质发生的电极反应不必写出)。
(2)NOx、SO2的大量排放是造成大气污染的主要原因,研究其处理方法,将其变废为宝越来越受到人们的重视,按要求回答下列问题。
①富集废气中的SO2,并使其与O2反应可制备硫酸,装置如图所示,X、Y均为多孔电极材料。

Ⅰ气体A是_______,X极的电极反应式为___________________________。
Ⅱ消耗5.6L(标准状况下)气体B时,通过质子交换膜的H+的个数为__________。
②SO2也可用于制备Na2S2O3,但产品常含有杂质。某 SO2制得的此产品,为测其纯度,准确称取Wg该产品,用适量蒸馏水溶解,配成100ml溶液,取20mL,以淀粉作指示剂,用0.2000 molL-1碘的标准溶液滴定。反应原理为: 2S2O32-+I2=S4O62-+2I-。滴定至终点时,溶液颜色的变化:_______________________________。消耗碘的标准溶液体积为20.00mL。求产品的纯度为(设Na2S2O3相对分子质量为M)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与图形相符合的是
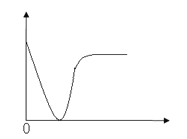
A. 稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B. 铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C. CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D. 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验所用仪器如图:
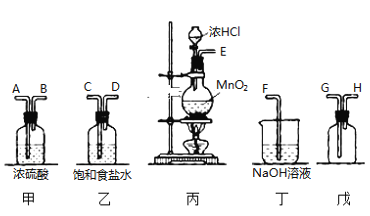
(1)连接上述仪器的正确顺序是 ________________________ 。
(2)气体发生装置中进行反应的离子方程式是_________________________;当0.5molMnO2反应时,生成的Cl2在标准状况下的体积约为 ________L。
(3)在装置中:乙中饱和食盐水的作用是___________________________,甲中浓硫酸的作用是_________________________。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸,如果有Cl2产生,可观察到的现象是____________________________,写出反应的化学方程式______________________________________。
(5)若用盛有过量烧碱溶液的小烧杯吸收标准状况下VL氯气,充分反应后,溶液中含等物质的量的次氯酸钠和氯酸钠,则反应消耗的NaOH的物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验装置进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是()

① | ② | ③ | ④ | |
A | 白色 | 先变红色后无色 | 橙色 | 蓝色 |
B | 无色 | 红色 | 橙色 | 紫色 |
C | 无色 | 白色 | 橙色 | 蓝色 |
D | 白色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com