
【题目】将下列物质,请按要求将序号填入下列空格内
A.35Cl和37Cl B.C60和石墨 C.![]() 和
和![]() D.异丁烷和2-甲基丙烷 E.CH2=CH-COOH和油酸(C17H33COOH)
D.异丁烷和2-甲基丙烷 E.CH2=CH-COOH和油酸(C17H33COOH)
(1)互为同位素的是________________;
(2)互为同系物的是_________________;
(3)互为同分异构体的是_____________;
(4)属于同一物质的是_________________;
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
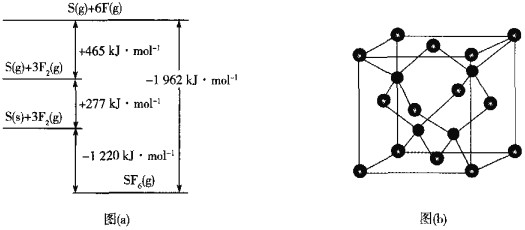
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
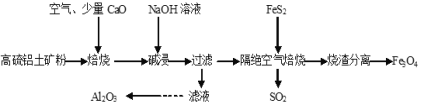
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
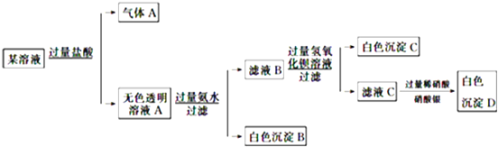
A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
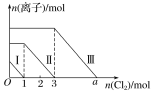
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用浓硫酸和乙醇制取乙烯,并验证探究乙烯与溴反应。实验装置如下(省略夹持、搅拌、加热装置)。
装置1 装置2
装置2 
请回答:
(1)仪器b的名称是_________;
(2)加热前,需将乙醇和浓硫酸混合。仪器a中盛装的是_________;
(3)乙醇制取乙烯的化学反应方程式为_________________;
(4)实验结果讨论:①甲同学观察到装置1中溴水颜色褪去,认为乙烯与溴水发生加成反应。化学反应方程式为____;
②乙同学观察到反应混合液逐渐变黑,认为乙烯中可能混有一种还原性气体,它也能使溴水颜色褪去。为证明乙烯能使溴水褪色,需将装置1虚线部分换成装置2,重做实验。装置2中,C所盛试剂是___;
③丙同学认为甲同学在观察实验现象时,漏掉一个能够证明乙烯与溴水发生了反应的重要实验现象。该现象是指_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
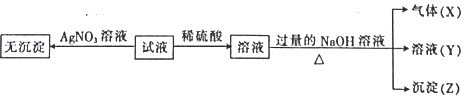
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
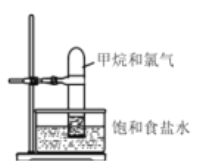
(1)油状液滴中属于非极性分子的电子式为________。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制________与水的反应。试管内液面上升的原因是________极易溶于水。
II.乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
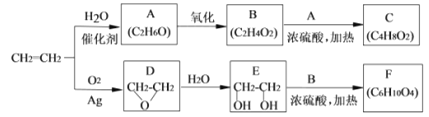
请回答下列问题:
(3)A的名称是________,含有的官能团名称是________。实验室A转化为乙烯的反应条件为________。
(4)B和A反应生成C的化学方程式为________,该反应的类型为________。
(5)F的结构简式为______________。
(6)写出D的同分异构体的结构简式__________________。
(7)乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。写出乙炔合成聚氯乙烯的合成路线。(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)______________
……目标产物)______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com