
【题目】
钒及其化合物在科学研究中和工业生产中具有许多用途。
(1)基态钒原子的核外价电子排布式为________。
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与VO43-空间构型相同的一种阳离子__________(填化学式)。
(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为________。
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是______________。
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有___________。
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
(5)已知单质钒的晶胞如图,则V原子的配位数是_______,假设晶胞的边长为d nm,密度ρ g·cm-3,则钒的相对原子质量为_______________。(设阿伏伽德罗常数为NA)

【答案】 3d34s2 +5 NH4+ 1:2 a d bc 8 5NAρd3×10-22
【解析】(1)钒是23号元素,基态钒原子的核外价电子排布式为3d34s2,故答案为:3d34s2;
(2)根据钒原子的核外价电子排布式为3d34s2可知,+5的钒最外层为8电子稳定结构,最稳定,故答案为:+5;
(3)VO43-空间构型为正四面体,与之具有相同结构的一种阳离子是NH4+,故答案为:NH4+;
(4)①CN-中含有C≡N三键,σ键和Π键数目比为1:2,故答案为:1:2;
②a.水中氧的杂化为sp3,[V(H2O)6]2+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故a错误;b. H2O与V2+形成[V(H2O)6]2+微粒的结构发生了变化,则化学性质发生改变,故b正确;c.水分子中的孤对电子与V2+形成了配位键,使得水分子中氢氧键(H-O)的夹角发生了改变,故c正确;d.H2O与V2+之间通过配位键相结合,配位键属于化学键,不属于分子间作用力,故d错误;故选ad;
③在[V(H2O)6]2+中存在的化学键有H2O与V2+间的配位键、水分子中的H-Oσ键,故选bc;
(5)单质钒的晶胞为体心立方,V原子的配位数为8;1个晶胞中含有2个V原子,1mol晶胞的质量为2Mg,1mol晶胞的体积为(d×10-7cm)3NA,则ρ=![]() g·cm-3,解得M=5NAρd3×10-22,故答案为:8;5NAρd3×10-22。
g·cm-3,解得M=5NAρd3×10-22,故答案为:8;5NAρd3×10-22。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)NH3、N2H4在工业生产和国防建设中都有广泛应用。
①N2H4(g)![]() N2(g)+2H2(g) △H1=akJ·mol-1
N2(g)+2H2(g) △H1=akJ·mol-1
②N2(g)+3H2(g)![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
③7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
则△H3=_________(用含a和b的代数式表示)
(2)N2中存在_________键(填“极性”或“非极性”),NH3的VSEPR模型是______________。用短线表示共价键,小黑点表示孤对电子的结构式叫路易斯结构式,NH4的路易斯结构式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为________;该温度时的平衡常数K=________。
(2)若反应温度升高,则M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时,液氨的电离跟水的电离相似,存在平衡:2NH3(l)![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
A. 在液氨中加入NaNH2,可使液氨的离子积变大
B. 此温度下液氨的离子积K为1×10-30
C. 在液氨中加入NH4Cl,液氨的离子积不变
D. 改变温度,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器: ①烧杯 ②蒸馏烧瓶 ③容量瓶 ④量筒 ⑤分液漏斗
⑥胶头滴管 ⑦玻璃棒 ⑧漏斗 ⑨酒精灯 ⑩温度计
在配制一定物质的量浓度的溶液时需用到的有_________。(填仪器的标号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为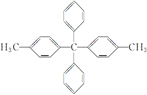 ,对该有机物分子的描述正确的是( )
,对该有机物分子的描述正确的是( )
A. 最多有7个碳原子共线
B. 所有碳原子都在同一平面上
C. 其一氯代物最多有5种
D. 最多有25个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是
A、Na与水反应时增大水的用量
B、将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C、在H2SO4与NaOH两溶液反应时,增大压强
D、恒温、恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com