
【题目】在-50℃时,液氨的电离跟水的电离相似,存在平衡:2NH3(l)![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
A. 在液氨中加入NaNH2,可使液氨的离子积变大
B. 此温度下液氨的离子积K为1×10-30
C. 在液氨中加入NH4Cl,液氨的离子积不变
D. 改变温度,液氨中c(NH4+)=c(NH2-)
【答案】A
【解析】仔细观察液氨的电离方程式,不难发现液氨的电离类似于水的电离,均属于“质子(H+)转移自偶电离”, 其中NH4+和NH2-分别相当于纯水中水电离出的H3O+和OH-。由此类比推出,液氨的性质应类似于水,如液氨可以与金属钠反应生成H2和NaNH2;影响液氨电离平衡的因素也类似于水。液氨的离子积(也应该只是温度的函数)为常数,此温度下会恒等于1×10-30。故A、液氨的离子积为常数,只与温度有关,温度不变,常数不变,选项A错误;B、此温度下液氨的离子积K为1×10-15mol·L-1×1×10-15mol·L-1=1×10-30 mol2·L-2,选项B正确;C、液氨的离子积为常数,只与温度有关,与浓度无关,温度不变,常数不变,选项C正确;D、改变温度,液氨中c(NH4+)、c(NH2-)同时改变,但c(NH4+)=c(NH2-),选项D正确。答案选A。


科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
A、75%的酒精溶液 B、硝酸钠
C、Fe(OH)3胶体 D、豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空:
(1)实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目;该反应中,氧化产物是 , 还原产物是 , 氧化产物与还原产物的物质的量之比是 .
(2)化学镀镍的溶液中含有Ni2+和H2PO2﹣在酸性条件下发生如下反应,请配平该反应.
Ni2++H2PO2﹣+→ Ni++H2PO3﹣+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为______________ ,其中心原子采取_________杂化;化合物N在固态时的晶体类型为_______________。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为___________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为__________(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为______________________________。
(5)Z原子基态时的外围电子排布式为_________________;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为____________。
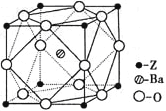
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钒及其化合物在科学研究中和工业生产中具有许多用途。
(1)基态钒原子的核外价电子排布式为________。
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与VO43-空间构型相同的一种阳离子__________(填化学式)。
(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为________。
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是______________。
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有___________。
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
(5)已知单质钒的晶胞如图,则V原子的配位数是_______,假设晶胞的边长为d nm,密度ρ g·cm-3,则钒的相对原子质量为_______________。(设阿伏伽德罗常数为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 △H =+Q kJ/mol(Q>0),获得如下数据:下列判断正确的是
2NO2 △H =+Q kJ/mol(Q>0),获得如下数据:下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.002 mol/( Ls)
C. 反应达平衡时,吸收的热量为0.30 Q kJ/mol
D. 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成的有机物只有一种的是
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2-氯丁烷(![]() )与NaOH乙醇溶液共热发生消去HCl分子的反应
)与NaOH乙醇溶液共热发生消去HCl分子的反应
C. 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D. 新戊烷和氯气发生取代反应生成一氯取代物的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 molL-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com