
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
【答案】 1×10-12 11 1×10-11mol/L a+b=14(或pH1+pH2=14)
【解析】本题主要考查有关水的离子积常数的计算。
(1)该温度下,水的离子积常数Kw=c(H+)c(OH-)=10-(a+b)=10-12。
(2)稀硫酸中c(H+)=0.2mol/L,NaOH溶液中c(OH-)=0.4mol/L,混合溶液中c(OH-)=(0.4-0.2)/2mol/L=0.1mol/L,c(H+)= 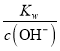 =
=![]() -mol/L=1×10-11mol/L,pH=11,此时该溶液中由水电离的c(OH-)=溶液中c(H+)=1×10-11mol/L。
-mol/L=1×10-11mol/L,pH=11,此时该溶液中由水电离的c(OH-)=溶液中c(H+)=1×10-11mol/L。
(3)该强酸溶液中c1(H+)=10-amol/L,该强碱溶液中c2(H+)=10-bmol/L,c(OH-)=10-(12-b)mol/L,混合后溶液呈中性,则100c1(H+)=10-a+2mol/L=c(OH-)=10-(12-b)mol/L,a+b=14,pH1=a,pH2=b,因此,pH1+pH2=14。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制取氨气的气体发生装置,请
结合所学知识,回答下列问题: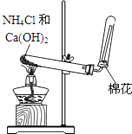
(1)图中用于加热的仪器名称是 , 收集氨气的方法是法.验证氨气是否已经收集满的方法是(任写一种).
(2)写出实验室制取氨气的化学方程式:
(3)若有5.35g氯化铵参加反应,则产生的氨气在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变的情况下,升高温度,下列数值不一定增大的是( )
①水解平衡常数 ②化学平衡常数 ③电离平衡常数 ④物质的溶解度
A.②③B.①④C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤的干馏和石油裂解得到的产物相同
B.2-甲基丁烷也称为异丁烷
C.C3H4和C4H6两者一定互为同系物
D.大多数有机物是非电解质,不易导电、熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3- B. AlO2-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3- D. Na+、NO3-、ClO-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时,液氨的电离跟水的电离相似,存在平衡:2NH3(l)![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
A. 在液氨中加入NaNH2,可使液氨的离子积变大
B. 此温度下液氨的离子积K为1×10-30
C. 在液氨中加入NH4Cl,液氨的离子积不变
D. 改变温度,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用废旧铝铜合金(含有少量杂质铁)制备Al(OH)3,流程如下:

回答下列问题:
(1)铝铜合金很坚硬,轻而抗张强度大,可代替昂贵的铜线为电线。但该合金暴露在空气中易被腐蚀,原因是___________________________。
(2)废旧铝铜用过量的稀硫酸浸取时,发生反应的化学方程式为________________。
(3)能溶解滤渣A而不产生空气污染的方法是___________________。
(4)在温度为358~368K时,加入Al2O3调节pH=1.6~1.8,析出黄铁矾[Na2Fe6(SO4)4(OH)12]。写出析出黄铁矾的离子方程式
(5)加NH3·H2O后将沉淀经过滤、_________、_________称量,得Al(OH)3质量为废旧铝铜合金质量的2.6 倍,则废旧铝铜合金含中Al的质量分数≤________%。
(6)Al(OH)3是塑料和有机聚合物的一种理想的阻燃剂填充料。塑料或聚合物与外部热源接触而燃烧时,可分为以下几个阶段:①加热,②分解,③起火,④燃烧,⑤蔓延。Al(OH)3阻燃起作用的阶段是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 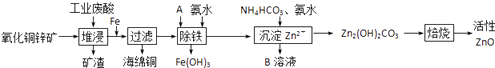
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com